МОДЕЛЬ СОПРЯЖЕНИЯ ПРОЦЕССА ГИДРОЛИЗА АТФ С
ВОЗБУЖДЕНИЕМ ВОДОРОДНЫХ СВЯЗЕЙ В БИОСИСТЕМАХ
С.В.Беспалова, А.М.Мищенко, В.М.Шаталов
(Донецк)
В работах К.Б. Толпыго с
соавторами по моделированию мышечного сокращения показана ключевая роль водородных связей в биосистемах,
поскольку кванты колебательной энергии водородного атома сравнимы с энергией
распада АТФ. Развивается модель сопряжения процесса гидролиза АТФ с
возбуждением водородной связи А–Н…В. В данной работе проведены оценки кулоновского
взаимодействия протона водородной связи с электрическим полем ковалентной связи
АДФ–Ф, рассчитаны адиабатические потенциалы системы АДФ–Ф–Н-связь.
Электрическое поле разрываемой ковалентной связи АДФ–Ф возбуждает колебания протона
приближающегося комплекса с водородной связью А–Н...В и смещает его из
положения равновесия в сторону указанной ковалентной связи, что приводит к
понижению барьера и к разрыву связи АДФ–Ф с выделением энергии в виде
кинетической энергии отделившейся фосфатной группы. Эта энергия затем переходит
в тепло, обуславливающее сближение рассматриваемых молекулярных комплексов АТФ
и А–Н...В.
MODEL OF COUPLING OF ATP HYDROLYSIS PROCESS AND EXCITATION OF HYDROGEN
BONDS IN BIOSYSTEMS
S.V. Bespalova, A.M. Mishchenko, V.M. Shatalov
(Donetsk)
In papers by K.B.Tolpygo and co-authors on simulation the muscle
contraction it was pointed the key role of hydrogen bonds in biosystems, since
the oscillatory energy of hydrogen atom is comparable to ATP dissociation
energy. In the development we calculate Coulomb interaction of hydrogen bond
A–H..В proton with the electrical field of the valence bond ADP–P. The
electrical field of the valence bond ADP–P excites the proton oscillations in a
complex with hydrogen bond A–H..B which is drawn nearby. It gives rise to
displacement of the proton from equilibrium to the pointed valence bond side.
This, in turn, causes a reduction of barrier and breaks up the valence bond
ADP–P. The process is accompanied with an energy release as a kinetic energy of
separated phosphate group. Then this energy transforms to the heat, which
causes the above-mentioned approaching of the molecular complexes ATP and
A–H..В. It should be noted that the process decreases the entropy of the
system.
Введение
В работах [1,2]
развивалась гипотеза о механизме мышечного сокращения, основанная на
предположении о природе тянущей силы, обязанной возбуждению водородных связей в
системе актин-миозин. При этом предполагалось, что возбуждение водородной связи
![]() сопряжено с процессом
гидролиза АТФ:
сопряжено с процессом
гидролиза АТФ: ![]() . Экспериментальные данные подтверждают близость энергии
гидролиза АТФ
. Экспериментальные данные подтверждают близость энергии
гидролиза АТФ ![]() к энергии возбуждения
протона на первый уровень в типичных Н-связях средней силы
к энергии возбуждения
протона на первый уровень в типичных Н-связях средней силы ![]() . Однако, остается открытым вопрос: как происходит разрыв АТФ и возбуждение водородной связи?
. Однако, остается открытым вопрос: как происходит разрыв АТФ и возбуждение водородной связи?
В работе [3]
предложен механизм сопряжения процесса возбуждения водородной связи с распадом
АТФ. Предполагалось, что при переходе
водородной связи в результате тепловой флуктуации в возбужденное состояние
понижается барьер, необходимый для разрыва макроэргической связи АДФ–Ф. Этот разрыв представляет
экзотермическую реакцию, если величина ![]() превосходит энергию
возбуждения водородной связи
превосходит энергию
возбуждения водородной связи ![]() .
.
Состояние протона
водородной связи в поле квадруполя АДФ–Ф и адиабатические потенциалы системы
На рис.1 показано возможное взаимное расположение молекулы
АТФ и комплекса с водородной связью![]() . Протон, образующий водородную связь движется в
асимметричном двухямном потенциале
. Протон, образующий водородную связь движется в
асимметричном двухямном потенциале ![]() , между атомами А и
В, причем
, между атомами А и
В, причем ![]() . При этом переход протона из нижайшего минимума вблизи атома
А в минимум вблизи атома В возможен лишь при поглощении энергии
примерно равной
. При этом переход протона из нижайшего минимума вблизи атома
А в минимум вблизи атома В возможен лишь при поглощении энергии
примерно равной ![]() . Энергия взаимодействия квадруполя АДФ–Ф с зарядом
. Энергия взаимодействия квадруполя АДФ–Ф с зарядом ![]() протона водородной связи есть:
протона водородной связи есть:
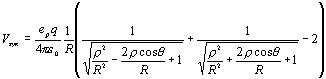 (1)
(1)
где q — заряд электрона; 2r — длина квадруполя; R — расстояние протона до центра квадруполя, ![]() — угол между
ковалентной связью АДФ–Ф и водородной связью. Причем притяжение наибольшее,
когда
— угол между
ковалентной связью АДФ–Ф и водородной связью. Причем притяжение наибольшее,
когда ![]() и
и ![]() — перпендикулярны.
— перпендикулярны.
Ранее было показано [4], что в основном состоянии протон
водородной связи ![]() движется в
окрестности атома А, а при возбуждении смещается в сторону атома В (или даже переходит к атому В). В
отсутствие Н–связи отталкивание положительных зарядов q ковалентной связи O–P в
молекуле АТФ скомпенсировано их притяжением к отрицательному заряду –2q пары электронов. При взаимодействии
протона Н–связи с зарядами квадруполя протон будет приближаться к центру
квадруполя, тем самым понижая энергию составной системы Н-связь-АДФ–Ф.
движется в
окрестности атома А, а при возбуждении смещается в сторону атома В (или даже переходит к атому В). В
отсутствие Н–связи отталкивание положительных зарядов q ковалентной связи O–P в
молекуле АТФ скомпенсировано их притяжением к отрицательному заряду –2q пары электронов. При взаимодействии
протона Н–связи с зарядами квадруполя протон будет приближаться к центру
квадруполя, тем самым понижая энергию составной системы Н-связь-АДФ–Ф.
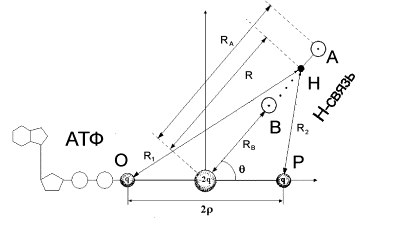
Рис. 1.
Предполагаемое взаимное расположение квадруполя связи О-Р молекулы АТФ и
водородной связи А-Н…В.
Для описания совместного движения протона и зарядов квадруполя использовалось адиабатическое приближение. При этом адиабатические потенциалы тяжелой подсистемы АДФ–Ф при различных состояниях водородной связи n=0,1,2…N равны:
![]() ,
, ![]() (2)
(2)
где ![]() — потенциальная
энергия взаимодействия групп АДФ и Ф,
— потенциальная
энергия взаимодействия групп АДФ и Ф, ![]() — энергии протона в
основном n=0 и возбужденном состояниях
соответственно n=N .
— энергии протона в
основном n=0 и возбужденном состояниях
соответственно n=N .
Адиабатический потенциал ковалентной связи построим в виде:
![]() (3)
(3)
где
![]() (4)
(4)
— обычный потенциал Морзе, причем ![]() . Параметры
. Параметры ![]() =3
=3![]() -1,
-1, ![]() =0.3
=0.3![]() -1,
-1, ![]() =0.5эВ, C=2.45эВ,
=0.5эВ, C=2.45эВ, ![]() =0.7
=0.7![]() . При таком выборе параметров потенциал (3) характеризуется барьером
для разрыва связи с высотой ~ 1эВ и
правильной асимптотикой 0.5 эВ.
. При таком выборе параметров потенциал (3) характеризуется барьером
для разрыва связи с высотой ~ 1эВ и
правильной асимптотикой 0.5 эВ.
Уравнение Шредингера для легкой подсистемы:
![]() (5)
(5)
где
![]() (6)
(6)
— гамильтониан для протона Н-связи в
поле квадруполя Vкул,
![]() — протонные волновые
функции в основном и возбужденном состояниях соответственно, зависящие от
координаты протона R, а также
параметрически от координаты r
фосфатной группы.
— протонные волновые
функции в основном и возбужденном состояниях соответственно, зависящие от
координаты протона R, а также
параметрически от координаты r
фосфатной группы.
Решение уравнения Шредингера для
протона для невысоких уровней энергии ![]() ищется в виде
разложения:
ищется в виде
разложения:
![]() (7)
(7)
при условии
![]() ,
,![]() (8)
(8)
Здесь ![]() — протонные волновые
функции в изолированных потенциальных ямах
— протонные волновые
функции в изолированных потенциальных ямах ![]() , которые находятся в аналитическом виде из решений уравнения
Шредингера в виде вырожденных гипергеометрических функций [4].
, которые находятся в аналитическом виде из решений уравнения
Шредингера в виде вырожденных гипергеометрических функций [4].
В соответствие с вариационным методом система вековых уравнений для определения коэффициентов разложения:
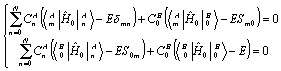 m=0,1,…N (9)
m=0,1,…N (9)
Единственное нетривиальное решение для ![]() ,
, ![]() может быть получено
при условии, что определитель составленный из коэффициентов при
может быть получено
при условии, что определитель составленный из коэффициентов при ![]() и
и ![]() равен нулю:
равен нулю:
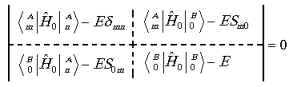 (10)
(10)
Подставляя полученные из детерминанта (10) значения энергии
в систему уравнений (9) находим коэффициенты разложения функции (7) ![]() и
и ![]() при условии (8).
при условии (8).
Таблица 1. Параметры модели
|
q, град |
ep, эВ |
q, эВ |
a, |
|
|
N |
RA-RB, |
êEN-E0
ê, эВ |
|
|
0,5 |
1 |
3 |
23 |
21 |
2 |
0,9 |
0,34 |
|
20 |
18 |
2 |
0,29 |
|||||
|
18 |
14 |
3 |
0,47 |
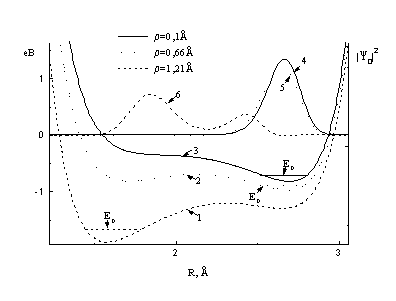
Рис. 2. Потенциальная энергия лёгкой подсистемы (кривые
1,2,3), соответствующие волновые функция ![]()
![]() (кривые 4,5,6) и
энергия
(кривые 4,5,6) и
энергия ![]() протона, для
различных значений параметра
протона, для
различных значений параметра ![]() , при b=18, b¢=14; RA=2.7Å, RB=1.8Å.
, при b=18, b¢=14; RA=2.7Å, RB=1.8Å.
Входящий в гамильтониан (6) кулоновский потенциал Vкул(R,r)
(1) приводит к зависимости от r уровней
энергии. Поэтому от r
будут зависеть коэффициенты ![]() ,
, ![]() и волновая функция (7).
В результате можно рассчитать адиабатические потенциалы системы U0(r),
UN (r)
в соответствие с (2).
и волновая функция (7).
В результате можно рассчитать адиабатические потенциалы системы U0(r),
UN (r)
в соответствие с (2).
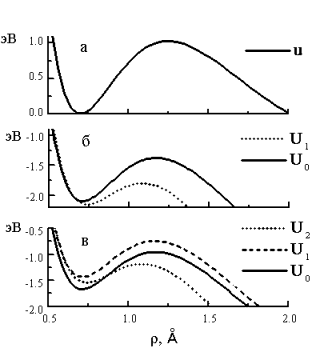
Рис. 3. Зависимость потенциальной
энергии взаимодействия групп АДФ и Ф от длинны
r связи АДФ-Ф (а) и адиабатические потенциалы Un (n=0,1…N) тяжелой подсистемы АДФ-Ф, при b=18, b¢=14 (б), и b=20, b¢=18 (в); RA=2.7Å, RB=1.8Å.
Полученные результаты
и обсуждение
В результате решения задачи совместного движения протона
Н-связи и зарядов квадруполя в адиабатическом приближении рассчитаны волновые
функции и энергия протона в зависимости от координаты r тяжелой подсистемы АДФ–Ф использованные при этом параметры
приведены в Таблице 1. На рис. 2 показана волновая функция легкой подсистемы ![]() для различных
значений r. Видно, что
вследствие взаимодействия протона с зарядами квадруполя происходит смещение
среднего положения протона связи
для различных
значений r. Видно, что
вследствие взаимодействия протона с зарядами квадруполя происходит смещение
среднего положения протона связи ![]() от атома А в
окрестность атома В (ближнего к
центру квадруполя). Как известно, протон на связи
от атома А в
окрестность атома В (ближнего к
центру квадруполя). Как известно, протон на связи ![]() движется в асимметричном
потенциале – более глубокая яма вблизи атома А. Поэтому в основном состоянии он
находится вблизи атома А, а в возбужденном – переходит ближе к атому В. Как
показывают наши расчеты, притягивающее кулоновское поле со стороны ковалентной
связи АДФ–Ф искажает эту картину – потенциальная яма у атома В понижается. В
результате порядок уровней меняется и более выгодным становится положение
протона у атома В. Это наглядно и иллюстрирует рис.2, где также представлена
рассчитанная зависимость потенциальной энергии протона водородной связи от
координаты r тяжелой подсистемы
АДФ–Ф. Видно, что с увеличением r (длины
ковалентной связи АДФ–Ф) меняется форма потенциальной функции. Причем, с ростом
r происходит более
существенное понижение локального минимума VB
по сравнению с VA , в
результате чего и происходит переход протона от атома A к атому B.
движется в асимметричном
потенциале – более глубокая яма вблизи атома А. Поэтому в основном состоянии он
находится вблизи атома А, а в возбужденном – переходит ближе к атому В. Как
показывают наши расчеты, притягивающее кулоновское поле со стороны ковалентной
связи АДФ–Ф искажает эту картину – потенциальная яма у атома В понижается. В
результате порядок уровней меняется и более выгодным становится положение
протона у атома В. Это наглядно и иллюстрирует рис.2, где также представлена
рассчитанная зависимость потенциальной энергии протона водородной связи от
координаты r тяжелой подсистемы
АДФ–Ф. Видно, что с увеличением r (длины
ковалентной связи АДФ–Ф) меняется форма потенциальной функции. Причем, с ростом
r происходит более
существенное понижение локального минимума VB
по сравнению с VA , в
результате чего и происходит переход протона от атома A к атому B.
На рис. 3 приведены насчитанные адиабатические потенциалы Un(r), n=0,1…,N (2) тяжелой подсистемы АДФ–Ф, соответствующие основному и возбужденному состояниям протона при различных параметрах потенциальных ям. Видно, что взаимодействие с протоном водородной связи приводит к понижению барьера для отрыва фосфатной группы от молекулы АТФ. Более того, при увеличении длины r термы U0 и UN пересекаются, и в этой точке вследствие отклонения от адиабатичности возможен переход в состояние с возбужденной Н-связью. Таким образом, переход протона в состояние N приводит к понижению барьера и такой канал распада АТФ становится энергетически более выгодным.
Модель сопряжения
распада АТФ с возбуждением водородной связи
Модель основана на следующих экспериментальных фактах:
¨ Распад АТФ происходит после встраивания молекулы в активный центр фермента.
¨ Энергия гидролиза АТФ примерно равна энергии возбуждения водородной связи.
¨ В результате распада АТФ активизируются конформационные изменения в макромолекулярных системах (мышечное сокращение, перенос заряда через биомембрану и т.д.).
Модель
1. В результате теплового
движения молекула АТФ встраивается в активный центр АТФ-азы, содержащей
водородную связь![]() . При этом посредством невалентных взаимодействий фиксируется
положение молекулы и определенная ориентация ковалентной связи
. При этом посредством невалентных взаимодействий фиксируется
положение молекулы и определенная ориентация ковалентной связи ![]() относительно
водородной связи
относительно
водородной связи ![]() .
.
2. После встраивания молекулы АТФ в структуру
фермента образуется составная взаимодействующая система из молекулы АТФ и комплекса ![]() с водородной связью.
с водородной связью.
Между протоном водородной связи ![]() и ковалентной связью
АДФ-Ф возникает кулоновское взаимодействие,
обусловленное неравномерностью распределения заряда ковалентной связи вдоль
линии связи АДФ–Ф.
и ковалентной связью
АДФ-Ф возникает кулоновское взаимодействие,
обусловленное неравномерностью распределения заряда ковалентной связи вдоль
линии связи АДФ–Ф.
3. Предположим, что
водородная связь ![]() направлена так, что
слабо связанный атом В находится ближе
к ковалентной связи АДФ–Ф, чем атом А (возможно, атом В является частью АДФ или фосфатной группы). Для простоты будем
считать, что часть
направлена так, что
слабо связанный атом В находится ближе
к ковалентной связи АДФ–Ф, чем атом А (возможно, атом В является частью АДФ или фосфатной группы). Для простоты будем
считать, что часть ![]() расположена
перпендикулярно линии связи АДФ–Ф.
расположена
перпендикулярно линии связи АДФ–Ф.
4. Расчеты показывают, что
кулоновское взаимодействие ковалентной связи ![]() молекулы АТФ с протоном водородной связи
молекулы АТФ с протоном водородной связи ![]() приводит к
перестройке энергетических уровней Н-связи, вследствие чего протон смещается в
сторону атома В (ближнего к молекуле АТФ).
приводит к
перестройке энергетических уровней Н-связи, вследствие чего протон смещается в
сторону атома В (ближнего к молекуле АТФ).
Величина искажения потенциальной
кривой и, следовательно, порядок расположения протонных уровней энергии зависит
параметрически от изменения длины ковалентной связи АДФ–Ф. Эти изменения
связаны с тепловыми колебаниями фосфатной группы. Колебания можно считать бесконечно
медленными по сравнению с колебаниями протона на связи ![]() из-за существенного
различия в массах. Поэтому здесь применимо адиабатическое приближение.
Фосфатная группа движется в потенциале, определяемом энергией "быстрой
подсистемы" — протона. Этот потенциал (для отрыва фосфатной группы Ф от
АДФ) определяется теперь тем, вблизи какого атома или на каком уровне энергии
находится протон. Таким образом, теперь имеются две ветви адиабатического
потенциала для отрыва Ф от АДФ, U0(r)
и UN (r).
из-за существенного
различия в массах. Поэтому здесь применимо адиабатическое приближение.
Фосфатная группа движется в потенциале, определяемом энергией "быстрой
подсистемы" — протона. Этот потенциал (для отрыва фосфатной группы Ф от
АДФ) определяется теперь тем, вблизи какого атома или на каком уровне энергии
находится протон. Таким образом, теперь имеются две ветви адиабатического
потенциала для отрыва Ф от АДФ, U0(r)
и UN (r).
5. Как следует из расчетов,
при увеличении длины связи АДФ–Ф основной
![]() и возбужденный
и возбужденный ![]() уровни протона
пересекаются, следовательно пересекаются и ветви адиабатического потенциала U0(r)
и UN(r). В точке пересечения наша система, совершающая
колебания в потенциале U0(r), может с какой-то вероятностью перейти на ветвь UN (r).
Это приводит к понижению барьера для отделения фосфатной группы и делает
возможным распад АТФ.
уровни протона
пересекаются, следовательно пересекаются и ветви адиабатического потенциала U0(r)
и UN(r). В точке пересечения наша система, совершающая
колебания в потенциале U0(r), может с какой-то вероятностью перейти на ветвь UN (r).
Это приводит к понижению барьера для отделения фосфатной группы и делает
возможным распад АТФ.
6. Химическая энергия, запасенная в молекуле АТФ выделяется (например) в виде кинетической энергии отделяющейся фосфатной группы после преодоления барьера. Эта энергия расходуется (может быть частично) на преодоления поля притяжения между протоном и уходящей на бесконечность фосфатной группой.
Заключение
Таким образом, в работе получен важный результат: взаимодействие молекулы АТФ с водородной связью приводит к изменению потенциального барьера, требуемого для разрыва связи АДФ–Ф, причем величина барьера зависит от квантового состояния протона – возбуждение протона приводит к понижению потенциального барьера для распада молекулы АТФ.
Список литературы:
1. Bespalova S.V., Tolpygo K.B.//J.Theor.Biol. 1991. V. 153, P.145-155.
2. Беспалова С.В., Толпыго К.Б.//Биофизика. 1996. Т.41, С.22-32.
3. Беспалова С.В., Толпыго К.Б.//Биофизика. 1998. Т.43, С.484-489.
4. Тележкин В.А., Толпыго К.Б., Толпыго С.К.//Укр.физ.журн. 1979. Т.24, С.1680-1688.