МАТЕМАТИЧЕСКИЕ МОДЕЛИ ФЕРМЕНТАТИВНЫХ
РЕАКЦИЙ В ЖИВЫХ СИСТЕМАХ
Васильева Л.Ю., Лапина Г.П.
(Тверь)
В работе применен комбинированный подход, включающий рассмотрение квантово-химических методов (теории кристаллического поля и теории поля лигандов) и нетрадиционных путей представления важнейших экспериментально определяемых ферментативных характеристик в трехмерной К¢мV¢ – системе координат для описания функционирования активного центра пероксидазы. Использование математических моделей в описании функционирования и механизма активного центра пероксидазы демонстрирует перспективность молекулярного и квантово-химического подходов в исследовании нелинейных процессов в живых системах.
МATHEMATICAL MODELS OF THE ENZYME FUNCTIONING IN LIVING SYSTEMS
Vasil’eva L.Yu., Lapina G.P.
(Tver)
This article is about complex approach of using quantum-chemical methods (crystal-field and ligand-fields theories) and untraditional ways of representation of the important enzyme characteristic changes in three-dimensional К¢мV¢-coordinata system. The using of the mathematical models of the peroxidase active center mechanism of the functioning working out on the bases of the molecular and quantum-chemical approach demonstrates its perspective in the research of non-linear process of the living systems.
На современном этапе исследований структуры и функций ферментов необходимо использовать комбинированный подход, включающий применение квантово-химических методов и нетрадиционных путей представления важнейших ферментативных характеристик в трехмерной К¢мV¢–системе координат. Среди множества окислительно-восстановительных ферментов пероксидаза (ПО) привлекает особое внимание исследователей из-за полифункциональности и широкой распространенности в различных живых организмах. ПО является гемопротеином. Центральный ион Fе(Ш) имеет шесть координационных мест. Основная функция гемопротеинов – удаление или нейтрализация перекиси водорода путем диспротопорфирирования и восстановления. Функционирование активного центра ПО состоит в переносе электрона и переходе центрального иона в высокоспиновое состояние на промежуточных стадиях формирования ЕS-комплекса. Особенностью механизма действия активных центров ПО является то, что, нейтрализуя перекись водорода через промежуточные соединения, фермент способен вернуться в исходное состояние. Процесс окисления идет очень быстро.
Применение теории кристаллического поля и теории поля лигандов [1] сделало возможным построить корреляционные диаграммы, позволяющие представить электронную структуру активного центра ПО. В работе получены качественные модели (схемы) распределения электронов центрального иона комплекса в поле лигандов и при взаимодействии с субстратом (Н2О2).
Групповые молекулярные орбитали (МО) преобразуются по определенным типам симметрии для октаэдра. Предполагается, что от центрального иона в образовании связи участвуют s-, р- и d-орбитали, а от лигандов — по одной s- и две p-орбитали. В октаэдрической системе s-орбиталь центрального иона участвует только в s-МО (Аg), две lg-орбитали (dz2 и d(x2-y2)) образуют двукратновырожденную s-МО (Еg), а три t2g-орбитали (dxy, dxz и dyz) — только p-МО (Т2g). Электронные конфигурации гемового железа Fe(II) – d6, Fe(Ш) -d5.
Основное состояние координационных систем в случае слабого поля лигандов (пептидные атомы азота создают слабое поле) можно представить следующим образом:
d5
– (t*2g)3(lg*)2 – A1g;
d6
– (t*2g)3(lg*)2 (t*2g¯)1– 5 T 2g;
d7
– (t*2g)3(lg*)2 (t*2g¯)2– 4 T 1g.
Лиганды, имеющие p-орбитали, взаимодействуют, как правило, с t2g-орбиталями иона металла. Если p-орбитали лиганда заполнены, то t2g-орбитали иона акцептируют электрон. Орбитали лиганда s-типа перекрываются с орбиталями иона с симметрией lg.
Во взаимодействии гемового железа с лигандами в активном центре железопорфиринов участвуют три орбитали – одна связывающая (s) и две разрыхляющие (верхние p-орбитали). Кроме того, со стороны белкового лиганда взаимодействуют пять орбиталей пептидного атома азота с неподеленными парами электронов. Пептидные атомы азота отдают на связь неподеленные пары электронов, которые размещаются на соответствующих МО, и один неспаренный электрон поступает на нижнюю МО.
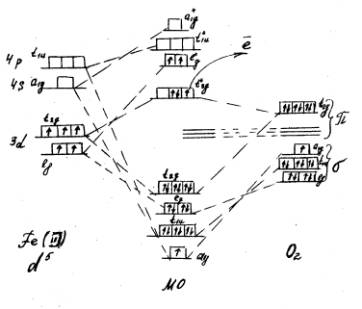
Рис. 1. Корреляционная диаграмма активного центра ПО, содержащего Fe (III) и взаимодействующего с О2
У молекулы кислорода остается один неспаренный электрон. Таким образом получается зафиксированный экспериментально комплекс Fe (II). Образование МО при взаимодействии центрального иона с молекулой кислорода идет по донорно-акцепторному механизму. Перераспределение электронов центрального иона на МО происходит таким образом, что образуется один неспаренный электрон на одной из разрыхляющих орбиталей, который затем уходит из комплекса, вызывая переход Fe(II)-Fe(III). Восстановление центрального иона в комплексе происходит за счет электрона, поступающего извне.
Применение экспериментального подхода и векторного метода [2] представления ферментативных параметров пероксидазы льна в трехмерной Км¢V¢–системе координат позволило рассмотреть случаи, которые до сих пор не поддавались рациональному количественному описанию. Построение хода изменений зависимостей ферментативных параметров — Км и V (Км ответственна за функционирование сорбционного, V — каталитического участка активного центра ПО) — пероксидазных реакций во времени начального развития льна (t) в трехмерной Км¢V¢–системе координат (рис. 2) дало возможность получить пространственную кривую пути протекания пероксидазной реакции на начальных этапах развития льна, визуализирующую одновременное действие нескольких факторов, ощутимо модулирующих активность пероксидазы льна [3].
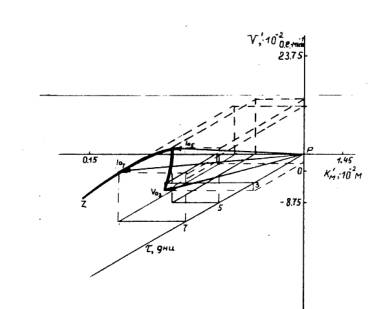
Рис. 2. Качественное математическое описание изменений ферментативных параметров ПО (Км и V) на начальных этапах роста льна путем построения “геометрических портретов” в трехмерной Км¢V¢–системе координат
Все три `Lа-вектора Км¢V¢-системы координат (рис. 2), формирующих ’’геометрический портрет’’ изучаемой пероксидазной реакции, принадлежат центрально-симметричному векторному пространству с началом в неподвижной точке Р (Kм0;V0;0). При соединении концов подвижных `La-векторов построена характеристическая кривая, отражающая специфику протекания пероксидазной реакции в динамике раннего развития льна. Направление смещений подвижных концов `La5- и `La7-векторов указывает направление установленного в работе изменения механизма протекания пероксидазной реакции на 5- и 7-й дни роста льна.
Расчет удалений (la), составляющих характеристическую кривую `La-векторов пероксидазных реакций от Рt-полуоси, позволил провести количественную оценку аддитивной (включающей одновременное изменение и Км-, и V-параметров) интенсивности активации пероксидазы проростков льна в условиях раннего роста по установленным типам активации фермента. Выявлено изменение исходного слабого Va-типа активации пероксидазы на 3-й день развития льна в сторону 9-кратно возросшей активации фермента по Ia-типу на 5-й и 7-й день роста льна.
Построение зависимости la-удалений (от Рt-полуоси трехмерной Км¢V¢-системы координат подвижных концов `La-векторов) от времени (t) проращивания семян льна и соединение la-точек огибающей линией дало возможность рассчитать значения `Sa-площадей под полученной кривой, которые являются интегральными характеристиками пероксидазных активностей и подчиняются не аддитивному, а векторному принципу суммирования и учитывают одновременные изменения ферментативных параметров (Км и V) и времени роста (t ) льна. Установлено [3], что на изученном отрезке времени (t)раннего развития льна (с 3-го по 7-й день) интегральная активность (`Sа) пероксидазы возрастает в 1,4 раза.
Таким образом, на основе качественной математической модели были рассчитаны дополнительные ферментативные параметры ПО, по которым установлены специфические закономерности функционирования фермента в условиях раннего развития растений льна.
Заключение
В статье обсуждены особенности функционирования активного
центра пероксидазы с позиции квантово-механических представлений и
молекулярного подхода. На электронном уровне показано, что механизм
функционирования фермента сводится к перераспределению электронов в активном центре
или на молекулярной орбитали фермент-субстратного комплекса. Причем, роль
белковой матрицы состоит в сохранении симметрии активного центра. Поступление и
приход электрона (взаимодействие с О2 (или Н2О2)
и разрушение фермент-субстратного комплекса с О2 (или Н2О2)
после протекания ферментативной реакции) приводит к изменению зарядового
состояния центрального иона Fе,
который затем восстанавливается электроном, поступающим извне. Это в свою
очередь приводит к изменению ионного радиуса центрального иона, длин связей
иона с лигандами. Но при этом требуется сохранение симметрии активного центра.
На этой стадии вклад в сохранение симметрии активного центра вносит белковый
матрикс, что неизбежно приводит к его конформационным изменениям. По-видимому,
измеряемые экспериментально ферментативные параметры пероксидазы являются
отражением этих конформационных вариаций, что и демонстрирует математическая
модель профиля пероксидазной реакции (рис. 2), изображенного в
трехмерной К¢мV¢–системе координат.
Список литературы:
1. Васильева Л.Ю. Взаимосвязь структуры и функций биологически активных соединений: учебное пособие. Тверской гос. ун-т. Тверь, 1995, 63 с.
2. Крупянко В. И. Векторный метод представления ферментативных реакций. М., 1990. 144 с.
3. Лапина Г.П. Молекулярные механизмы изменчивости пероксидазы льна и их регуляция: монография. Тверь. 1999. c. 230.