«ПРОПЕЛЛЕРОВОЕ» ВОДОРОДНОЕ СВЯЗЫВАНИЕ
НУКЛЕОТИДОВ В СТРУКТУРЕ ДВОЙНЫХ МИНИ-СПИРАЛЕЙ.
КВАНТОВО-ХИМИЧЕСКИЕ РЕЗУЛЬТАТЫ.
Комаров В.М., Кабанов А.В., Шаповалов А.В., Канапин А.А.
(Пущино, Томск)
С использованием MNDO-PM3 конформационных расчетов
рассмотрена задача о стабильности пропеллеро-подобных форм Н-связывания
уотсон-криковских пар в условиях «стэкинга» в структуре коротких двойных
спиралей олигонуклеотидов.
“PROPELLER” HYDROGEN BONDING OF NUCLEOTIDES IN SHORT
DOUBLE HELIXES.
QUANTUM CHEMICAL RESULTS.
Komarov V.M., Kabanov A.V., Shapovalov A.V., Kanapin A.A.
(Pushchino, Tomsk)
The stability of propeller-like forms of Watson-Crick base-pairing is considered in “stacking” conditions in the structure of oligonucleotide double helixes by using quantum-chemical semi-empirical MNDO-PM3 technique.
Введение
Основной целью настоящей работы является теоретическое обоснование сохранения «пропеллеровой» некопланарности Н-связывания одиночных канонических пар при образовании коротких двойных спиралей. В литературе доминирует «стэкинговая» гипотеза о возможном слабом деформировании «исходно плоских» Уотсон-Криковских пар в двойных цепочках полинуклеотидов [1,2]. Однако она не позволяет единым и непротиворечивым образом описать экспериментальные данные о значительных разворачиваниях и «сдвиговых» изломах пар при формировании структуры синтетических и нативных форм ДНК [3,4]. В то же время для успешного решения проблемы зависимости вторичной структуры молекул нуклеиновых кислот от первичной последовательности крайне важно четкое понимание механизма накопления возникающих деформаций пар. Ранее [5-7] мы уже отмечали нетривиальность самого механизма спаривания одиночных нуклеотидов, с неоднозначностью геометрии Н-связывания оснований. В данном сообщении на примере конформационных расчетов коротких двойных цепочек олигонуклеотидов решается, прежде всего, задача о стабильности полученных нами ранее разных форм Н-связывания А-Т и G-C пар в условиях двойной спирали. Рассматривается роль концевых эффектов в процессах начальной укладки различных типов последовательностей нуклеотидов.
Метод
Для расчетов структурных, спектроскопических и
термодинамических свойств модельных дуплексов d(ApA).d(TpT), d(ApApA).d(TpTpT),
d(TpApTp).d(ApTpA), d(ApApApA).d(TpTpTpT), d(GpG).d(CpC), d(GpGpG).d(CpCpC) и
d(CpG).d(CpG)
мы использовали хорошо зарекомендовавшую себя полуэмпирическую квантово-химическую MNDO-РМ3 методику [8] программного пакета MOPAC6.0. Все структуры рассматривались в стационарных состояниях, в действительных минимумах поверхности потенциальной энергии. Контроль осуществлялся по отсутствию мнимых частот в низкочастотном спектре нормальных колебаний комплекса. Рассчитывались антипараллельные цепочки с нейтральной, в основном, формой сахаро-фосфатного скелета. Нейтральность моделировалась добавлением протона (Н+) к одному из анионных кислородов (=О-) фосфатной группы. Использовалось стандартное определение торсионных углов двухспиральных полинуклеотидов, взятое из работы [1]. С целью сравнительной оценки устойчивости левоспиральной структуры одиночного дуплекса был также проведен оптимизационный расчет Z-формы альтернирующего комплекса вида [(CpG).d(CpG)]‑2.
Результаты и их
обсуждение
MNDO-PM3 рассчитанные характеристики структуры дуплексов приведены в Таблицах 1 и 2. Из анализа всех полученных результатов вытекает следующее:
1. Газофазная модель
изолированных коротких двойных цепочек олигонуклеотидов показывает устойчивый
характер возникающей у них правовинтовой спиральной В-формы. При этом, у
наиболее протяженного димера — тетрануклеодида АААА-ТТТТ – многие конформационные параметры
спирали уже хорошо коррелируют с известными аналогичными усредненными
параметрами для классической В-формы ДНК, полученными из рентгеноструктурных
данных. Причем лимитирующим фактором в формировании правовинтовой закрутки
двойной спирали выступает сравнительно жесткая структура сахарофосфатного
остова с С2,-endo конформацией фуранозных колец. Z-форма отрицательно заряженного дуплекса
[(CpG).d(CpG)]-2 также характеризуется, как показал расчет,
устойчивой структурой, но обладает своим отличительным спектром торсионных
параметров и конформацией фуранозных колец уже близкой к С3,
-endo.
Полученные разные значения параметра R для соседних цепей
дуплексов отражают накапливающуюся кривизну спиралей с ростом их размеров, как
следствие разной природы связывающихся олигонуклеотидов. Весьма также
показательны и растущие при этом величины дипольных моментов спиралей. Тоже
нетривиальное свойство электронной структуры таких комплексов, могущее иметь
важное значение для понимания функциональных свойств двойных спиралей.
2. Некопланарная,
«пропеллеровая» форма спаривания нуклеотидов, выявленная нами ранее [5,6] для одиночных АТ и GC пар, остается
основной формой Н-связывания и
в структуре рассмотренных двойных цепей. Причем углы пропеллера и излома пар в
дуплексах могут достигать, как это показано в таблице 2, значительной величины,
порядка 200 –300. Для структуры альтернирующих
нуклеотидных дуплексов возможно проявление также и второй полиморфной формы
Н-спаривания оснований – сдвиговой формы типа «ступеньки» [5,6]. Однако здесь, в
отличие от изолированных пар, концевые эффекты дуплекса приводят к
дополнительным искажения данной формы с появлением пропеллерового закручивания
и излома пары. Наиболее четко чувствительность формы Н-спаривания оснований к
длине цепи, а также некоторые проявления внутренней лабильности двойной спирали,
можно видеть из приведенного на рисунке стереоизображения оптимизированных
конформаций тримерного и тетрамерного нуклеотидных дуплексов. Нетрудно
заметить, что концевые эффекты возмущения стэкинговой укладки пар в обоих
структурах довольно значительны. Вместе с тем, увеличение размеров спирали
приводит к закономерному ослаблению этих эффектов для внутренних Н-спариваний,
обуславливая почти параллельное расположение оснований в середине цепи.
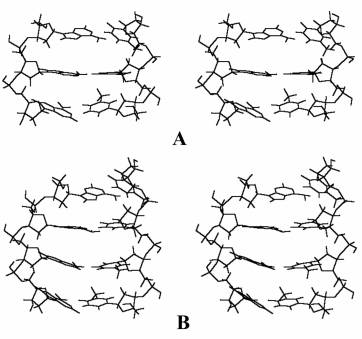
Рисунок. Стереоизображение MNDO-PM3 оптимизированных
структур олигонуклеотидных дуплексов d(ApApA).d(TpTpT) – А и
d(ApApApA).d(TpTpTpT) – В.
3. Рассчитанные в данном
(хартри-фоковском) приближении энтальпии водородного связывания пар в цепи, таблица
1, оказываются по порядку величины сравнимыми с оцененными нами ранее
значениями энергий Н-спаривания одиночных нуклеотидных пар [7]. В то же время с ростом длины
двойной спирали они несколько возрастают и отражают вклад цепочечных
релаксационных эффектов в энергетику стабилизации водородно-связанного
комплекса. Следует заметить, что при этом сами длины водородных связей в целом
не отличаются от таковых длин для одиночных пар и лежат, согласно расчетам, в
пределах 2.81¸2.83
А . Обращает на себя внимание весьма малая величина энергии водородных связей
дуплекса [(CpG).d(CpG)]-2.
Но это и следовало ожидать учитывая сильное влияние кулоновского отталкивания
отрицательных зарядов фосфатных групп боковых цепей.