СОЕДИНЕНИЕ КВАНТОВОХИМИЧЕСКОГО И МОЛЕКУЛЯРНОГО ПОДХОДОВ В СОЗДАНИИ МАТЕМАТИЧЕСКОЙ МОДЕЛИ ФУНКЦИОНИРОВАНИЯ ОКСИДАЗ
(Тверь)
Обсуждена общность молекулярного механизма окисления
субстрата различными оксидазами (пероксидаза, о-дифенолоксидаза, полифенолоксидаза). Рассмотрен
квантовохимический механизм
функционирования ферментов, что нашло отражение в предложенной математической
модели, построенной в виде
корреляционных диаграмм.
THE COMBINATION OF
THE QUANTUM-CHEMICAL AND THE MOLECULAR METHODS OF APPROCH TO THE MATHEMATICAL
MODELING OF THE OXIDASES FUNCTIONING
Vasil’eva L.,Yu.,
Lapina G.P.
(Tver)
The common molecular mechanism of the substrate
oxidation by different oxidases is
explained with the similar active center structures. This is made possible to
consider the unit quantum-chemical mechanism of the oxidases functioning. It is
discussed the mathematical model of the oxidase functioning in the form of
correlative diagram.
Применение теории поля лигандов и известные литературные данные о функционировании ферментов класса оксидаз позволяют представить взаимодействие активного центра таких ферментных молекул с субстратом следующим образом. Функционирование активного центра любого фермента с точки зрения квантовой химии определяется природой лигандов (т.е. ближнего окружения центрального иона), природой центрального иона, первичной последовательностью аминокислот, структурой активного центра, в которой белковая составляющая макромолекулы “охраняет” активный центр. Любое перераспределение электронов в области гема вызывает электронно-конформационные изменения макромолекулы в целом, что сохраняет конфигурацию активного центра и создает условия для восстановления иона железа. Комплекс с Fе (V) может восстанавливаться аминокислотными остатками, углеводами, связанными с белком, с образованием сначала Fе (IV), а потом Fе (III).
Применение точных расчетных методов к подобным
системам проблематично. Использование основных положений теории поля лигандов позволяет получить
качественную математическую модель распределения электронов на молекулярных
орбиталях комплекса при взаимодействии активного центра с субстратом.
Для построения модели необходимо:
а) отнести
комплекс к определенной точечной группе
симметрии;
б) молекулярные орбитали (МО) комплекса выразить в виде линейной комбинации атомной орбитали центрального атома и групповых орбиталей лигандов.
При сортировке атомных орбиталей необходимо:
а) отнести атомную орбиталь центрального иона к тем или иным типам симметрии;
б) определить тип симметрии групповых орбиталей лигандов;
в) скомбинировать полученные атомные и групповые орбитали, принадлежащие одному и тому же типу симметрии [1].
Ион Fе (III) имеет 6 координационных мест (октаэдр), 5 из
которых идут на связь с белковым лигандом через атомы азота пептидной связи
(слабое поле лигандов), отдающие на связь неподеленные пары электронов, а
центральный ион в комплексе – вакантные орбитали. Субстрат – в нашем случае
бензидин – взаимодействует через неподеленную пару атома азота. Предполагается,
что от центрального иона в образовании связи участвуют s-, p- и d-орбитали, а от лигандов – по одной s- и по две p-орбитали. В октаэдрической системе s-орбиталь центрального иона участвует только в s-МО (Ag),
две eg – орбитали (dz2,
dx2
– y2)
образуют двукратновырожденную s-МО (Еg), а
три t2g – орбитали (dxy, dxz, dyz) – только p-МО (T2g). Распределение электронов на МО комплекса
представлено на корреляционной диаграмме.
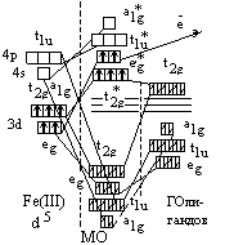
Рис. 1. Корреляционная диаграмма
электронного строения активного центра комплекса при взаимодействии с
бензидином.
При взаимодействии с субстратом активного центра фермента имеют место следующие изменения зарядового состояния центрального иона:
Fе (III) ® Fе (IV) ® Fе (V).
Распределение электронов на молекулярных орбиталях комплекса центрального иона выглядит следующим образом [3]:
Fе (III)
- d5 (t*2g)3 ( e*g)2
Fе (IV) – d4 (t*2g)3 ( e*g)1
Fе (V) – d3 (t*2g)3.
Схема расчета.
Энергии МО определяются из уравнения Шредингера:
Е = ∫Y*ĤYdv/∫Y*Ydv, где Ĥ-эффективный гамильтониан,
Hik = ∫Y*iĤYk dv = b для соседних пар;
Hii = ∫Y*iĤYi dv = a кулоновские инт.;
Sik = ∫Y*iYк dv – инт. перекрывания.
Для модели фрагмента – активного центра фермента составляется система из 6 уравнений
∑cik ( Hik -
ESik) = 0 или
С11(a- Е) + С12b21 + --- + C1nb1n = 0
C21 b21 + С22(a- Е) + --- +C2nb2n = 0
……………………………………….
……………………………………….
Cn1 bn1 + --- + Cnn(a- Е) = 0
где Cij –
коэффициент атома j на i-той МО, занятой n электронами, E = a
+ kb, a
= a0 + h0b0 , b
= gх
b0 ,a0,
b0,
h0 –
поправки, q =∑ Cij2 ∫Y2
dv – электронная
плотность.
Таблица групповых орбиталей лигандов для октаэдрического комплекса
НР АО s-тип p-тип
группы ц.а.
Оh
А1g
s 1(s1 + s2 + s3 +s4 +s5 + s6) ¤ Ö6 —
T1i px 1(s2 - s6) ¤ Ö2 (p1-p4+p3-p6) ¤2
py 1(s3 - s6) ¤ Ö2 (p1-p4+p2-p6) ¤2
py 1(s1 - s4) ¤ Ö2 (p2-p5+p3-p6) ¤2
Eg dx2-y2 1(s2 + s5 - s3 - s6) ¤ 2 —
dz2 1(2s1 + 2s4 - s2 -s3 - s5 - s6) ¤Ö12 —
T2g dxz — (p2+p5+p1+p4) ¤2
dyz — (p3+p6+p1+p4) ¤2
Молекулярные
ферментативные параметры оксидаз. Субстратами
для оксидаз (пероксидаза, о-дифенолоксидаза, полифенолоксидаза) могут быть
вторичные амины, в частности бензидин, в результате окисления которого
образуется соединение синего цвета. Схема окисления бензидина выглядит
следующим образом :
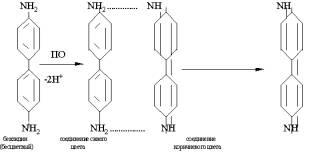
Измерение ферментативных параметров оксидазной реакции позволило получить набор каталитических характеристик, которые имеют свои численные значения для всех изученных оксидаз (табл. 1) [2].
Таблица 1. Ферментативные параметры оксидаз
|
Фермент |
Км ·105, М |
Ккат , с-1 |
|
Пероксидаза |
3,5 |
33 |
|
О-дифенолоксидаза |
85,0 |
80 |
|
Полифенолоксидаза |
60,0 |
120 |
Предполагаем, что выявленные экспериментально различия в эффективности функционирования оксидаз связаны с различающимся окружением активного центра ферментов, которое является строго специфичным для каждой из изученных оксидаз и приводит к формированию индивидуальных для каждого фермента третичных структур белковых глобул.
Таким образом, различные значения экспериментально полученных каталитических параметров окислительно-восстановительных ферментов отражают специфичность первичной (и третичной) структуры каждой из изученных оксидаз.
Общность молекулярного механизма окисления субстрата различными оксидазами обьясняется сходными структурами активного центра. Это позволяет рассматривать единый квантовохимический механизм функционирования ферментов, что нашло отражение в предложенной математической модели, построенной в виде корреляционных диаграмм.
Список литературы:
1.Васильева Л.Ю. Взаимосвязь структуры и функций биологически активных соединений: учебное пособие. Тверской гос. ун-т. Тверь, 1995, 63 с.
2.Лапина Г.П. Молекулярные механизмы изменчивости пероксидазы льна и их регуляция: монография. Тверь. 1999. c. 230.
Бкерсукер И.В. Электронное строение и свойства координационных соединений. Л.: Химия. 1976.С. 350.