АЛГОРИТМ ОЦЕНКИ ПО ТЕРМОДИНАМИЧЕСКИМ ДАННЫМ ВЕРХНЕГО ПРЕДЕЛЬНОГО ЗНАЧЕНИЯ ЭНТАЛЬПИИ РАЗРЫВА ХИМИЧЕСКОЙ СВЯЗИ В ГАЗОВОЙ ФАЗЕ
Дудоров
В.В., Мельчакова Т.А., Мишанов А.Р.
(Нижний Новгород)
Предложены алгоритм и вычислительная программа для
установления предельных значений энтальпии и энтропии разрыва химической связи
в газовой фазе из условия равенства нулю приращения энергии Гиббса системы в
реакции диссоциации. Показано, что эти величины могут быть использованы для
определения энтальпий и энтропий активации реакций диссоциации и рекомбинации в
газовой фазе.
VALUE ALGORITHM
FOR ENTHALPY TOP RATE DEFINITIONAT CHEMICAL BOND DISSOCIATION IN GASEOUS PHASE
Dudorov V.V.,
Melchakova T.A., Mishanov A.R.
(Nizhnii Novgorod)
Algorithm and calculation program are proposed for
enthalpy and enthropy top values definition of chemical bond dissociation in gaseous
phase from equal mark between Gibbs energy increase at dissociation reaction
and nought. These values have been to indicate may be utilize at activation
enthalpy and activation enthropy definition for dissociation and recombination
reactions.
Одной из основных целей определения энтальпий разрыва химических связей является расчет энергий разрыва соответствующих связей. Последнее объясняется, в частности, тем, что согласно экспериментальным данным энергия активации элементарной газофазной реакции термической диссоциации химической связи R1-R2 в молекуле R1R2 обычно практически совпадает с энергией разрыва этой связи [1], равной, в соответствии с определением [2], величине:
DH°0 = D°0(R1-R2) = DH°f,0 (R1) + DH°f,0 (R2) -DH°f,0 (R1-R2) (1)
где DH°0 – энтальпия разрыва связи, DH°f,0 - этальпии образования из простых веществ фрагментов R1, R2 и молекулы R1R2 при температуре 0 К.
Теоретическое объяснение достаточности величины (1) (не учитывающей работу расширения системы в реакции диссоциации) для разрыва химической связи при температурах выше 0 К отсутствует. В связи с этим представляют интерес оценка верхнего предельного по температуре значения энтальпии разрыва химической связи, установление его связи с величиной (1) и попытка объяснения явления достаточности этой величины для разрыва химической связи при любой температуре.
Существование верхних по температуре предельных значений термодинамических характеристик молекул и химических связей в газовой фазе не вызывает сомнений. Однако обсуждению возможности оценки таких величин должного внимания не уделялось, по-видимому, вследствие отсутствия в научной литературе общепринятого положения о предельном, верхнем по температуре, состоянии молекулы (химической связи) в газовой фазе. Известное представление [3,4] о критической температуре существования молекул, как температуре, при которой все молекулы в системе предельно активированы и способны диссоциировать, является идеализированным, так как понятие температуры имеет статистический смысл. В статистической термодинамике при описании какой-либо системы с помощью функций по состояниям, обычно принимают, что с температурой макросостояния совпадает лишь средняя статистическая температура невзаимодействующих микросостояний макросистемы. Упомянутое представление может быть корректным только при рассмотрении идеализированной макросистемы, состоящей из микросистем с одинаковой энергией. Допустив, что подобная макросистема является замкнутой и образована одним молем газообразного вещества, условие равновесия процесса диссоциации молекулы R1R2 можно представить в виде:
DG*(R1-R2) = DH*(R1-R2) - T*×DS*(R1-R2) = 0 (2)
где T* – предельная (критическая) температура существования термодинамически устойчивой химической связи, DG*, DH*,×DS* - энергия Гиббса, энтальпия, энтропия разрыва связи при достижении такой температуры.
На примере расчета энтальпии разрыва химической связи можно убедиться, что соотношение (2) справедливо и для макросистемы, образованной множеством невзаимодействующих микросистем – молекул с различной энергией, при условии, если величина Т* совпадает со значением их средней статистической температуры.
Действительно, в группе термических методов для определения величины (1) рекомендуется [2] использование уравнения:
DH°0 = Т×(DФ*T - R×Ln(Kp) (3)
где Т - температура, при которой измерено значение Kp , DФ*T - изменение в реакции диссоциации приведенного термодинамического потенциала: Ф*T = - (G°Т - H°0 ) ¤ T, где G°Т – энергия Гиббса.
Нетрудно видеть, что при условии Kp= 1 уравнение (3) сводится к соотношению (2). Таким образом, предельное по температуре состояние химической связи соответствует температуре макросистемы, при которой выполняется условие Kp= 1. Выше этой температуры равновесие сдвинуто в сторону процесса диссоциации связи, существовать при этом могут, скорее всего, лишь молекулы, энергосодержание которых меньше средней статистической энергии микросистем, составляющих макросистему. Существование перегретых молекул (химических связей) в условиях столкновительного молекулярного движения представляется маловероятным. Это позволяет в качестве верхних, предельных по температуре макросистемы , термодинамических характеристик химических связей в газовой фазе принять величины, удовлетворяющие соотношению (2).
На основании вышеизложенного для оценки предельного значения энтальпии разрыва химической связи мы воспользовались уравнением (2) по специально разработанным алгоритму и программе расчета на компьютере с помощью справочных данных [5].
Алгоритм оценки предусматривал расчет в допустимом интервале температур по табличным данным [5] приращений энергии Гиббса системы в газофазной реакции диссоциации молекулы, указанной в табл. 1, и последующее определение предельных величин, удовлетворяющих выполнению условия (2). Установление равенства (2) состояло в определении координат и параметров точки перемены знака функциональной зависимости DGr(R1-R2) = f(T), где DGr(R1-R2) – приращение энергии Гиббса системы в реакции диссоциации.
Программа определения величин, удовлетворяющих выполнению условия (2), была написана на языке Turbo-BASIC для IBM-PC [6]. Важнейший фрагмент вычислительной программы имел вид:
1675 GKT0
= 0
1680 GKT1
= 0
1685 FOR I = 1 TO (M-1)
1690 IF SGN(GKT0) <> SGN(GKT1) THEN 1770
1695 K = I-1
1700 GKT0 = DGr(R1-R2)
[K]
1705 GKT1 = DGr(R1-R2)
[I]
1710 KT0 = T[K]
1715 KT1 = T[I]
1720 IF SGN(GKT0) <> SGN(GKT1) THEN
1725 GT0 = DGr(R1-R2)
[K-1]
1730 GT1 = DGr(R1-R2)
[I+1]
1735 TK0 = T[K-1]
1740 TK1 = T[I+1]
1745 HKT0 = DHr(R1-R2)
[K]
1750 IHKT = DHr(R1-R2)
[I] - DHr(R1-R2)
[K]
1755 SKT0 = DSr(R1-R2)
[K]
1760 ISKT = DSr(R1-R2)
[I] - DSr(R1-R2)
[K]
1765 END IF
1770 NEXT I
1775 IF GKT1 > 0 THEN 2170
1780 DGKT0 = (GKT0 – GT0) / (KT0 - TK0)
1785 DGKT1 = (GKT1 - GKT0) / (KT1 - KT0)
1790 DGKT2 = (GT1 - GKT1) / (TK1 - KT1)
1795 IF ABS(GKT0) >= ABS (GKT1) THEN
1800 TKT1 = KT0 - GKT0/ DGKT1
1805 TKT2 = KT1 - GKT1/ DGKT2
1810 END IF
1815 IF ABS(GKT0) < ABS (GKT1) THEN
1820 TKT1 = KT0 - GKT0 / DGKT0
1825 TKT2 = KT1 - GKT1/ DGKT1
1830 END IF
1835 TKT = SQR( TKT1* TKT2)
1840 HKT = HKT0 + IHKT*(TKT-KT0) / (KT1-KT0)
1845 SKT = SKT0 + ISKT*(TKT-KT0) / (KT1-KT0)
1850 GKT = HKT - SKT*TKT
1855 DTKT = SQR(ABS(TKT1-TKT)*ABS(TKT-TKT2))
1860 PRINT “Погрешность предельной температуры”, DTKT
2110 PRINT “Предельная температура”
2115 PRINT TKT
2120 PRINT “Предельные величины термодинамических характеристик”
2125 PRINT “ Энтальпия “; “ Энтропия “; “ Энергия Гиббса “
2130 PRINT HKT; SKT; GKT
2170 PRINT “Объем выборки данных недостаточен”
Полученные для случая наиболее изученных газообразных молекул расчетные значения приведены в табл. 1. в сопровождении расчетных величин энергий разрыва связей, найденных с помощью уравнения (4):
D°0(R1-R2)) = DH0r,Т* (R1-R2) - RТ* (4)
где R – газовая постоянная, Т- абсолютная температура.
Достоверность полученных данных подтверждается тем, что величины Т* для всех исследованных молекул (веществ) совпали со значениями температур, при которых согласно справочным данным [5] константа равновесия процесса диссоциации газообразного вещества обращалась в единицу.
Из сопоставления данных табл .1 следует, что для двухатомных и даже для некоторых трехатомных молекул с достаточно удовлетворительным приближением энергия разрыва химической связи равна разности энтальпии образования связи и работы расширения системы при температуре Т*. Более точная зависимость может быть получена на основании известного закона Кирхгофа. Тем не менее, наличие в соотношении (4) слагаемого, равного величине RT*, может свидетельствовать о том, что даже в предельных условиях существования молекула приобретает примерно только две степени свободы вращательного движения.
Установление связи между энергией активации и предельной энтальпией разрыва химической связи возможно в рамках реакции диссоциации: R1R2 « R1 + R2, протекающей согласно принимаемой в теории переходного состояния (активированного комплекса) схеме [7]:
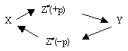
где Z¹ - промежуточный комплекс, символы +р и -p указывают, что в направлении прямой реакции количество движения этого комплекса имеет положительный знак, а в направлении обратной реакции - отрицательный при одинаковом химическом составе и геометрической структуре комплекса, если происследовать решения системы:
(DH0r,Т* (R1~R2))(®) + DH0f,Т* (R1-R2) = DH0f,Т* (R1~R2)
(DH0r,Т* (R1~R2))(¬) + DH0f,Т* (R1)
+ DH0f,Т* (R2) = DH0f,Т* (R1~R2) (5)
(DH0r,Т* (R1~R2))(®) + (DH0r,Т* (R1~R2)) (¬) = D°0(R1-R2)
где (DH0r,Т* (R1~R2))(®) и (DH0r,Т* (R1~R2)) (¬) - соответственно энтальпии процессов образования переходного состояния (активированного комплекса) в реакциях диссоциации и рекомбинации химической связи R1-R2 , DH0f,Т* (R1~R2) – энтальпия образования переходного состояния из простых веществ при температуре Т*.
Решения системы (5) имеют вид:
(DH0r,Т* (R1~R2))(®) = (DH0f,Т* (R1) + DH0f,Т* (R2) - DH0f,Т* (R1-R2) + D°0(R1-R2)) ¤ 2 (6)
(DH0r,Т* (R1~R2))(¬ ) = (DH0f,Т* (R1-R2) - DH0f,Т* (R1) - DH0f,Т* (R2) + D°0(R1-R2)) ¤ 2 (7)
DH0f,Т*
(R1~R2) = ((DH0f,Т*
(R1-R2) + DH0f,Т*
(R1) + DH0f,Т* (R2) + D°0(R1-R2))
¤ 2 (8)
Полагая,
что активационный барьер реакции диссоциации химической связи из равновесного состояния
активированного комплекса при температуре T* совпадает с величиной (6), на основании формул (1) и (6) для его
описания получим выражение:
Еакт = (DH0r,0 (R1-R2)
+ (DH0r,Т* (R1-R2))
¤ 2 (9)
откуда следует необходимость специального расчета величины DH0r,Т* (R1-R2) для определения значения энергии активации (9), которое должно быть несколько больше (1), (см. формулы (1), (4)), но также удовлетворяет условию постоянства в некотором интервале температур.
Величина (9), по-видимому, является
минимально возможной, поэтому более вероятным представляется протекание реакций
термической диссоциации-рекомбинации химических связей в газовой фазе через
образование равновесного состояния активированного комплекса в условиях
справедливости равенства (2).
В достаточно продолжительный период между столкновениями газообразный активированный комплекс можно рассматривать в качестве изолированной системы, приращение энтропии которой в состоянии равновесия, как известно, должно обращаться в нуль. Очевидно, что этому условию должна удовлетворять величина алгебраической суммы энтропий образования и разрушения активированного комплекса в равновесном состоянии, что позволяет написать систему уравнений:
(DS0r,Т* (R1~R2))(®) + S0f,Т* (R1-R2)
= S0f,Т* (R1~R2)
(DS0r,Т* (R1~R2))(¬) + S0f,Т* (R1) +
S0f,Т* (R2) = S0f,Т* (R1~R2) (10)
(DS0r,Т* (R1~R2))(®) + (DS0r,Т* (R1~R2)) (¬) = 0
где (DS0r,Т* (R1~R2))(®) и (DS0r,Т* (R1~R2)) (¬) - соответственно энтропии процессов образования переходного состояния (активированного комплекса) в реакциях диссоциации и рекомбинации химической связи R1-R2 , S0f,Т* (R1~R2) – энтропия образования переходного состояния из простых веществ при температуре Т*.
Решения системы (10) имеют вид:
(DS0r,Т* (R1~R2))(®) = (S0f,Т* (R1) + S0f,Т* (R2) – S 0f,Т* (R1-R2)) ¤ 2 (11)
(DS0r,Т* (R1~R2))(¬ ) = (S0f,Т* (R1-R2) - S0f,Т* (R1) - S0f,Т* (R2)) ¤ 2 (12)
S0f,Т*
(R1~R2) = (S0f,Т* (R1-R2)
+ S0f,Т* (R1) + S0f,Т*
(R2)) ¤ 2 (13)
В соответствии с величиной (11), являющейся константой, энтропия активации реакции диссоциации химической связи из равновесного состояния активированного комплекса в условиях справедливости равенства (2) должна быть равна половине полной энтропии реакции при этой температуре:
DSакт = (DS0r,Т* (R1~R2))(®) - (DS0r,Т* (R1~R2))(¬) ¤ 2 (14)
Таким образом, для определения
энтропии активации реакции диссоциации, по-видимому, достаточно расчета
величины DS0r,Т* (R1-R2).
Таблица 1. Предельные термодинамические характеристики химических связей
|
Связь |
Предельные характеристики |
Энергия разрыва связи, DE*, кдж×моль-1, рассчитанная по уравнению: DE* = DH* - R×T* |
Литературные данные |
||
|
Т*, К |
DH*, кдж×моль-1 |
DS*, дж×моль-1×К-1 |
|||
|
O-O |
3807,62 |
514,50 |
135,12 |
482,84 |
493,11 ± 0,17 |
|
H-O |
3902,07 |
454,48 |
116,47 |
422,04 |
423,31 ± 0,17 |
|
H-H |
3719,76 |
462,27 |
124,27 |
431,344 |
431,656 ± 0,013 |
|
H-F |
4744,23 |
603,34 |
127,17 |
563,90 |
565,1 ± 1,3 |
|
H-Cl |
3864,35 |
458,06 |
118,54 |
425,93 |
427,36 ± 0,33 |
|
H-Br |
3424,44 |
391,23 |
114,25 |
362,76 |
362,16 ± 0,21 |
|
H-J |
2913,74 |
316,91 |
108,76 |
292,69 |
294,36 ± 0,84 |
|
F-F |
1305,51 |
166,28 |
127,37 |
155,43 |
154,66 ± 2,09 |
|
Cl-Cl |
2083,36 |
254,80 |
122,30 |
237,479 |
238,987 ± 0,013 |
|
F-O |
1957,77 |
229,32 |
117,13 |
213,04 |
217 ± 17 |
|
HO-O |
2277,48 |
294,42 |
129,28 |
275,49 |
261,7 ± 8,3 |
|
HO-OH |
1541,56 |
216,93 |
140,72 |
204,11 |
206,9 ± 2,5 |
|
S-H |
3468,97 |
376,74 |
108,60 |
347,90 |
340,3 ± 11,7 |
|
N-S |
4284,25 |
505,43 |
117,97 |
469,81 |
460 ± 21 |
|
N-F |
2679,01 |
306,99 |
114,59 |
284,72 |
293 ± 84 |
|
P-P |
4122,95 |
516,85 |
125,36 |
482,57 |
485,13 ± 0,38 |
|
P-O |
5157,15 |
629,43 |
122,05 |
586,55 |
593,6 ± 10,5 |
|
P-S |
4130,29 |
467,53 |
113,20 |
433,19 |
443 ± 17 |
|
P-F |
4107,28 |
461,45 |
112,35 |
427,30 |
460 ± 42 |
|
P-Cl |
3020,94 |
315,28 |
104,37 |
290,16 |
284 ± 42 |
|
Ge-Ge |
2696,02 |
281,83 |
104,54 |
259,42 |
272 ± 13 |
|
Ge-O |
5148,46 |
696,39 |
135,26 |
653,59 |
652,9 ± 7,9 |
|
Ge-S |
4536,20 |
585,67 |
129,11 |
547,96 |
546,7 ± 5,0 |
|
Ge-F |
4719,23 |
543,94 |
115,26 |
504,70 |
481 ± 21 |
|
Ge-Cl |
4090,58 |
442,83 |
108,26 |
408,82 |
405 ± 25 |
|
Pb-Pb |
1129,47 |
87,48 |
77,46 |
78,09 |
96 ± 21 |
|
Pb-O |
3522,36 |
405,20 |
115,04 |
375,92 |
372,0 ± 5,0 |
|
B-B |
2697,39 |
293,74 |
108,90 |
271,31 |
276 ± 21 |
|
B-Cl |
4864,94 |
588,45 |
120,96 |
548,00 |
543 ± 21 |
|
B-Br |
3951,42 |
463,37 |
117,27 |
430,52 |
431 ± 21 |
|
Al-H |
2896,84 |
311,94 |
107,68 |
287,86 |
284,2 ± 5,0 |
|
Al-S |
3439,50 |
370,41 |
107,69 |
341,81 |
368 ± 8 |
|
Al-N |
3795,48 |
363,55 |
95,78 |
331,99 |
355 ± 42 |
Список
литературы:
1.Веденеев В.И., Кибкало А.А. Константы скорости газофазных мономолекулярных реакций. Справочник. М.: Наука. 1972.
2.Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. М.: Наука. 1974.
3.Нонински Х.И. // Химия и индустрия (Бълг.). 1967. Т. 39. №9. С. 405-406.
4.Нонински Х.И. // Химия и индустрия (Бълг.). 1969. Т. 41. №5. С. 156-158.
5.Термодинамические свойства индивидуальных веществ. М. Т. 1-4. 1978-1982 гг.
6.Кетков Ю.Л. GW-, Turbo- и Quick-BASIC для IBM PC. М.: Финансы и статистика. 1992.
7.Кондратьев В.Н. Кинетика
химических газовых реакций. М. 1958.