ВЛИЯНИЕ СВЯЗАННОЙ ВОДЫ НА СТУКТУРООБРАЗОВАНИЕ КОРОТКИХ
ДВОЙНЫХ СПИРАЛЕЙ ОЛИГОНУКЛЕОТИДОВ. MNDO/PM3 РАСЧЕТЫ
Кабанов
А.В., Комаров В.М., Якушевич Л.В., Канапин А.А., Теплухин А.В.
(г. Пущино, Московской области)
Рассматривается роль связанной воды в изменении
структурной организации изолированного короткого олигонуклеотидного дуплекса
d(ApA).d(TpT). На основе оптимизационных MNDO/PM3 расчетов показано уменьшение
влияния концевых эффектов на упаковку пар оснований. Образование водных
«сшивок» межу основаниями в стопке улучшает стэкинг пар.
INFLUENCE OF BOUND
WATER ON STRUCTURE ORGANIZATION OF SHORT OLYGONUCLEOTIDE DUPLEXES. MNDO/PM3
CALCULATIONS
Kabanov A.V.,
Komarov V.M., Yakushevich L.V., Kanapin A.A., Tepluhin A.V.
(Pushchino, Moscow region)
The role of bound water in structural organization
of isolated olygonucleotide duplex d(ApA).d(TpT) is considered. On the basis of
MNDO/PM3 calculations the decrease of influence of end effects on the base
pairs packing is shown. Stacking of the bases is improved by cross-linked water
molecules.
Введение
Структурообразование двойной спирали ДНК, формирование зависимости торсионных параметров вторичной структуры от нуклеотидной последовательности остается одной из важнейших проблем физико-химической биологии.
Ранее, на примере газофазных самокомплементарных двух-, трех- и четырех-нуклеотидных дуплексов различного состава, начиная с простых дуплексов типа d(ApA).d(TpT) и d(GpG).d(CpC) и заканчивая смешанными структурами типа d(ApTpGpC).d(GpCpApT), мы теоретически обосновали определяющую роль множественности непланарных форм спаривания канонических АТ и GC пар [1-5] в инициировании гетерогенности структурных параметров нуклеотидных шагов по длине спирали. Было отмечено значительное влияние концевых эффектов на упаковку пар оснований в спирали.
Из анализа геометрических конфигураций и распределения электрического заряда в рассмотренных нами коротких олигонуклеотидных дуплексах был, также, получен эффект накопления с ростом длины цепи нескомпенсированного электрического дипольного момента вдоль оси спирали в структуре антипараллельных 3'-5' двойных цепочек. Сделан вывод о возможно значительной роли обнаруженного эффекта в процессах белково-нуклеинового узнавания, в обенностях процесса функционирования молекул ДНК.
Однако, поскольку реальные биологические структуры функционируют не в газофазной, а в гидратной среде, в данной работе мы, с использованием приближения супермолекулы, сделали попытку оценить уже влияние связанной воды на изменение структурообразования двойной спирали.
Метод исследования и результаты
В качестве объекта оптимизационных расчетов был выбран пример короткого дуплекса d(ApA).d(TpT) с суммарным зарядовым состоянием фосфатов DZe = – 2. Cтартовая конфигурация дуплекса бралась из базы данных нуклеиновых кислот [6]. Вокруг “замороженного” затравочного комплекса были рассмотрены два варианта водных “оболочек”, содержащих большее и меньшее число молекулы воды. При этом молекулы воды распределялись с учетом возможностей образовывать с азотистыми основаниями как короткие “сшивки” (из одной молекулы воды), так “водные мостики” (из двух или трех молекул воды) см. рис. 1. Для оценок структурных, спектроскопических и термодинамических свойств дуплекса в водном окружении мы, как и ранее, использовали хорошо зарекомендовавшую себя полуэмпирическую квантово-химическую MNDO-РМ3 методику свободно распространяемого программного пакета MOPAC 7.01. Все структуры рассматривались в стационарных состояниях, в действительных минимумах поверхности потенциальной энергии. Контроль нахождения оптимизированных структур в глобальном минимуме потенциальной энергии осуществлялся по отсутствию мнимых частот в низкочастотном спектре нормальных колебаний комплексов.
Полученные
оптимизированные конформации дуплекса d(ApA).d(TpT) с двумя разными составами связанной
воды приведены на Рис. 1. В Таблице представлены некоторые структурные
характеристики полученных комплексов.
Для сравнения, там же приведены результаты оптимизации изолированного (в
вакууме) нейтрального дуплекса, взятые
из нашей предыдущей работы [4].
Как видно из рисунка, разный состав с разным распределением связанной воды вокруг оснований синициировали, прежде всего, стабилизацию разных ориентаций N-H связей пирамида льных амино-групп оснований относительно плоскости молекулы основания. Иными словами – синициировались разные формы скрытого полиморфизма Н-спаривания нуклеотидов. При этом, если в первом водном окружении реализовалась синхронная, “up” ориентация N-H-связей амино-группы обоих оснований аденинов, то в другом водном комплексе наиболее выгодной по энергии оказалась противоположная - “down” ориентация связей. В случае же изолированного дуплекса наиболее устойчивой оказывается антибатная ориентация наклонов N-H-связей амино-групп аденинов. У одного из них реализуется “up”, а у другого – симметричная, “down” ориентация N-H связей группы –NH2.
Главный же
результат заключается в том, что в таком коротком олигонуклеотидном дуплексе, в
отсутствии соседних оснований “сверху” и “снизу” сказывается влияние различных “водных цепочек” образующихся из
молекул связанной воды, которое несколько видоизменяет характер упаковки пар по
сравнению с конформацией изолированного дуплекса. С одной стороны такое окружение
нейтрализует в определенной степени влияние концевых эффектов цепочек, а с
другой, из-за возникновения водных «сшивок» между плоскостями пар оснований в
спирали, наблюдается компактизация комплекса и
появляется стэкингоподобная
укладка пар.
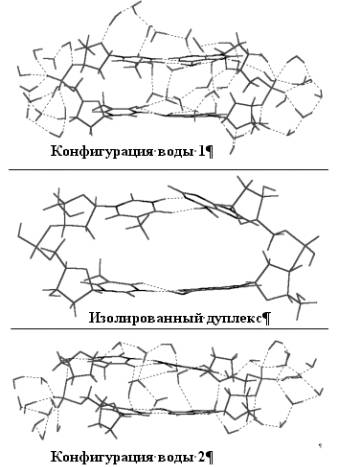
Рис
1. Влияние связанной воды на конфигурацию дуплекса d(TpT)·d(ApA).

Следует также отметить, что обнаруженный ранее эффект появления нескомпенсированного электрического дипольного момента вдоль оси вращения нуклеотидных пар (т.е. вдоль оси двойной спирали) в изолированных дуплексах [5] сохраняется, как показал наш расчет, и в этом случае комплексов с водным окружением. Включение воды в дуплекс хотя и несколько нивелирует некопланарную укладку пар в сахарофосфатной двойной цепочке не убирает, однако, пропеллероподобную деформированность водородного связывания азотистых оснований по неплоским аминогруппам и не устраняет, таким образом, первопричину возникновения значительной составляющей дипольного момента вдоль оси спирали. Поэтому, сделанный нами ранее вывод о возможной существенной роли возникающих больших дипольных моментов в изолированных нуклеотидных двойных цепочках в процессах белково-нуклеинового взаимодействия остается, на наш взгляд, справедливым и при учете поправок на связанное водное окружение, которое всегда существует в структуре молекулы ДНК.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, Грант 99-04-48162.
Список литературы:
1.Комаров В.М., Кабанов А.В., Лазарев Ю.А., Шаповалов А.В., Труды VI Международной конференции: "Математика, Компьютер, Образование", Москва, "Прогресс-Традиция", т.6., с. 405-411, (1999)
2.Комаров В.М., Кабанов А.В., Хечинашвили Н.Н., Шаповалов А.В., Труды VII Международная конференции "Математика, Компьютер, Образование", Москва, Прогресс-Традиция, т.7, с.658-662, (2000).
3.Комаров В.М., Кабанов А.В., Шаповалов А.В., Канапин А.А., Труды VIII Международной конференции "Математика, Компьютер, Образование", Москва, Прогресс-Традиция, т.8, с. 214-218, (2001)
4.Комаров В.М., Кабанов А.В.,Труды 4 Международной конференции по математическому моделированию, Москва, Изд. "СТАНКИН", т.2, c. 209-222 (2001)
5.A.V. Kabanov, V.M. Komarov, Int. J. Quant. Chem., "Polymorphism
of Hydrogen Bonding in the Short Double Helixes of Oligonucleotides. Quantum-Chemical Semiempirical Study",
(2002) (in press)
6.ATLAS of Nucleic Acid Containing Structures, http://ndb.sdsc.edu/NDB/NDBATLAS