КИНЕТИЧЕСКАЯ МОДЕЛЬ ПЕРВИЧНЫХ ПРОЦЕССОВ ФОТОСИНТЕЗА В ХЛОРОПЛАСТАХ. АНАЛИЗ СОСТАВА ФЛУОРЕСЦЕНТНОГО СИГНАЛА В БЫСТРОЙ ФАЗЕ ИНДУКЦИОННОЙ КРИВОЙ ПРИ РАЗЛИЧНЫХ ИНТЕНСИВНОСТЯХ СВЕТА
Лебедева
Г.В., Беляева Н.Е., Демин О.В., Ризниченко Г.Ю., Рубин А.Б.
(Москва)
Разработана кинетическая модель, описывающая систему
генерации и потребления трансмембранного электрохимического градиента
протонов DmH+ в
первичных процессах фотосинтеза в хлоропластах. Учтена зависимость скоростей реакций
электронного переноса от величины трансмембранного электрического потенциала.
Модель применена к описанию экспериментальных данных по регистрации быстрой
фазы индукции флуоресценции хлорофилла при различных интенсивностях освещения
объекта (от высоких до низких). Для каждой интенсивности света проанализирован
состав флуоресцентного сигнала.
KINETIC MODEL OF
PRIMARY PHOTOSYNTHETIC PROCESSES. ANALYSIS OF FLUORESCENCE SIGNAL COMPOSITION
IN THE FAST PHASE OF CHLOROPHYLL FLUORESCENCE INDUCTION AT DIFFERENT LIGHT
INTENSITIES
G.V. Lebedeva,
N.E. Belyaeva, O.V. Demin, G.Yu. Riznichenko, A.B. Rubin
(Moscow)
Kinetic model is developed describing the system of
generation and consumption of transmembrane electrochemic proton potential DmH+ in primary photosynthetic processes. The dependence
of the electrone transfer rates on the value of transmembrane electric
potential is taken into account. The model is applied to the description of the
experimental data on the registration of the fast phase of fluorescence
induction. The model is shown to give realistic desription of the fast phase of
induction curves at different light intensities (from high to low). Composition
of fluorescence signal is analyzed for each light intensity.
Введение
Для изучения состояния фотосинтетического аппарата растений традиционно используется информация, которую несет флуоресценция хлорофилла [1-4]. В этом отношении одним из наиболее важных явлений является эффект индукции флуоресценции – изменение во времени интенсивности флуоресценции адаптированного к темноте объекта, возникающее в ответ на включение постоянного освещения. Регистрируемые индукционные кривые отражают процесс адаптации растения к новым условиям освещения и являются полифазными (см. вставку к рис. 1), что определяется устройством фотосинтетической системы, включающей в себя процессы, различающиеся по своим характерным временам. В настоящее время принято выделять следующие основные фазы и параметры индукции флуоресценции хлорофилла: быстрая фаза – возрастание интенсивности флуоресценции от начального уровня FO до максимального FP за времена порядка 1 секунды, и медленная фаза – релаксация интенсивности флуоресценции к некоторому стационарному уровню FT за времена порядка десятков секунд. Характер быстрой фазы зависит от интенсивности освещения. При низкой интенсивности света обычно наблюдается одна промежуточная фаза (I), а при высокой интенсивности – не менее двух (J, I)
Для интерпретации экспериментальных результатов традиционно применяются методы математического моделирования, позволяющие изучать кинетику фотосинтетических процессов, приводящих к появлению индукционных эффектов [5-13]. Большинство имеющихся моделей, описывающих быструю фазу индукционной кривой, в силу используемых в них упрощений применимы лишь для объяснения определенных «частных случаев» экспериментальных кривых флуоресценции. Так, в работах [14, 5] рассматривается индукция флуоресценции хлорофилла в присутствии ингибитора электронного транспорта диурона (DCMU), когда на индукционной кривой отсутствуют промежуточные фазы. Другие модели [6-8] описывают быструю фазу индукционной кривой в условиях низкой интенсивности освещения. И, напротив, в работах [9, 15] представлены модели, разработанные для описания быстрой фазы индукции флуоресценции при высокой интенсивности освещения.
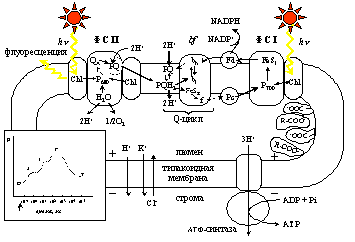
Рис.1. Общая схема процессов, рассматриваемых в обобщенной модели первичных процессов фотосинтеза. ФС I, ФС II – фотосистемы I и II, bf – цитохромный bf комплекс, Chl – хлорофилл антенны, P680 и P700 – пигменты реакционных центров фотоситем II и I. QA – первичный хинонный акцептор электронов ФС II, bl и bh – низко- и высокопотенциальный гемы цитохрома b, FeSR –железосерный центр Риске, f – цитохром f, FeSI – акцепторный комплекс ФC I, PQ – пластохинон; PQH2 – пластохинол; Fd – ферредоксин, Pc – пластоцианин. R-COO- – буферные группы. Знаки «+» и «-» показывают, что в результате протекания фотосинтетических процессов внутренний компартмент тилакоида (люмен) заряжается положительно, а строма хлоропласта – отрицательно. Жирные стрелки обозначают кванты света и флуорсеценции. Тонкими стрелками показано направление переноса электронов по цепи электронного транспорта и потоки ионов H+ K+ и Cl- сквозь тилакоидную мембрану после включения освещения. На вставке приведена схема кривой индукции флуоресценции хлорофилла с общепринятыми обозначениями фаз. Стрелкой на оси абсцисс показан момент включения постоянного освещения.
Большинство моделей, разработанных для изучения быстрой фазы индукции флуоресценции, ограничиваются рассмотрением процессов в фотосистеме II, поскольку именно ее хлорофилл вносит основной вклад в регистрируемую флуоресценцию. Вместе с тем, за рамками модели остаются другие процессы, способные влиять на параметры первичных фотореакций, в частности, процессы генерации трансмембранного электрохимического градиента протонов DmH+ с участием комплексов фотосистемы I и цитохромного bf комплекса, а также процессы потребления DmH+ при синтезе АТФ и в результате пассивных утечек ионов Н+, K+ и Cl–
В нашей работе мы предлагаем обобщенную модель первичных фотосинтетических процессов, интегрирующую в себе основные современные представления об устройстве и функционировании системы фотосинтеза зеленых растений. Отдельные аспекты модели обсуждались ранее в [16-20], поэтому в данной работе мы не приводим подробного описания модели, а ограничиваемся рассмотрением ее общей структуры. Основное внимание мы акцентируем на детальном анализе полученных теоретических результатов, а именно, на анализе природы отдельных кинетических компонентов быстрой фазы индукционной кривой при различных интенсивностях освещения объекта.
Общая структура модели
Разработанная нами модель первичных процессов фотосинтеза является компартментальной и описывает события, происходящие в трех основных компартментах хлоропласта – строме хлоропласта, тилакоидной мембране и люмене тилакоида. Общая схема рассмотренных процессов представлена на Рис.1.
Под действием света инициируется перенос электрона по цепи электронного транспорта и сопряженный трансмембранный перенос протонов из стромы хлоропласта в люмен тилакоида, в результате чего на тилакоидной мембране формируется электрохимический градиент протонов DmH+, имеющий электрическую (Dy) и концентрационную (DpH) составляющие.
В генерации DmH+ принимают участие высокоспециализированные пигмент-белковые комплексы фотосистемы II и I (ФС II и ФС I), а также комплекс цитохром- bf. Потребление DmH+ происходит в процессах синтеза АТФ, катализируемого АТФ-синтазой, а также в результате утечек ионов H+, K+, Cl– сквозь энергизованную мембрану тилакоида, и при оттоке электронов от ФС I в реакции, катализируемой ферментом ферредоксин НАДФН редуктазой.
Модель является кинетической и представляет собой систему обыкновенных дифференциальных уравнений, которая в каждый момент времени определяет состояние рассматриваемой системы химических реакций, т. е. задаёт концентрации метаболитов этой совокупности реакций как функции времени. Эти уравнения носят балансовый характер и записываются следующим образом
dXi/dt = vпр(.Xi) – vпотр. (.Xi) (1)
Здесь Xi – концентрация i-го метаболита системы , измеряемая в мМ; vпр(.Xi) и vпотр. (.Xi) – суммарные скорости его производства и потребления, измеряемые в мМ/c.
Основные принципы построения модели и подробное описание отдельных
ее блоков были опубликованы нами ранее в [16-20].
Результаты
и обсуждение
Разработанная модель первичных процессов фотосинтеза в хлоропластах растений была применена для расчета теоретических кривых индукции флуоресценции хлорофилла при различных интенсивностях освещения объекта. Моделирование осуществлялось для трех уровней освещенности (15, 150 и 1500 квантов/с на РЦ ФС II). Для расчета относительного выхода флуоресценции в каждый момент времени после включения освещения в модели использовалась функция F, представляющая собой сумму концентраций флуоресцирующих состояний ФСII, умноженных на отношение константы флуоресценции и световой константы ФС II.
Все результаты были получены для среднего объема хлоропласта 40 mм3, содержания Р700 равного 2 ммоль на 1 моль хлорофилла, и соотношения объемов стромы хлоропласта, люмена тилакоида и тилакоидной мембраны 10:1:1. Cоотношение содержания комплексов ФС II, bf, ФС I, молекул пластохинона PQ и пластоцианина Pc в мембране тилакоида предполагалось равным 1:1:1:6:2 соответственно.
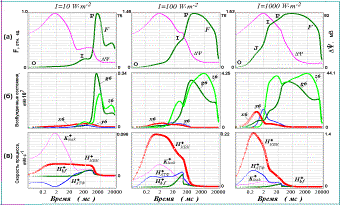
Рис. 2. Индукционные эффекты, рассчитанные с помощью модели первичных процессов фотосинтеза для трех разных интенсивностей освещения объекта: 1000, 100 и 10 (1%) Вт×м–2. Рисунки, расположенные в одном столбце, соответствуют одинаковому уровню освещенности. Результаты показаны на логарифмической шкале времени.
а) относительный выход флуоресценции (F) и значение трансмембранного электрического потенциала (DY);
б) концентрации различных возбужденных состояний ФС II;
в) скорости процессов, генерирующих и потребляющих электрический заряд в люмене тилакоида: H+bf – поток протонов в люмен при окислении пластохинола на люменальной стороне bf комплекса; H+КВК – поток протонов в люмен от кислородвыделяющего комплекса ФС II; H+АТФ – скорость потребления протонов люмена в АТФ-синтазной реакции; K+leak – скорость утечки ионов K+ из люмена тилакоида.
Результаты моделирования быстрых индукционных эффектов фотосинтеза приведены на рис.2. Как видно из рис.2(а), при малых значениях световых констант, соответствующих низкой освещенности (1%), выход флуоресценции достигает своего максимума за времена порядка 1-2 с, при этом кинетика нарастания флуоресценции характеризуется наличием одной промежуточной фазы («плеча») I на временах порядка 200 мс. Увеличение освещенности объекта в 10 раз (10%), приводит к возрастанию амплитуды сигнала, сдвигу максимума флуоресценции по шкале времени влево (времена порядка 500 мс). В кинетике нарастания флуоресценции также наблюдается промежуточная фаза I, однако она не столь явно выражена. При высокой освещенности пик флуоресценции достигается за время порядка 100-200 мс и кинетика нарастания характеризуется наличием двух промежуточных фаз (J – около 2 мс, и I - около 20 мс). Эти результаты находятся в соответствии с имеющимися экспериментальными данным по индукции флуоресценции в различных условиях освещения объекта
Для исследования природы отдельных кинетических компонентов начального участка индукционной кривой нами были построены зависимости от времени концентраций тех состояний фотосистемы II, которые способны излучать кванты флуоресценции. Результаты моделирования показали, что при любой интенсивности освещения вклад во флуоресценцию состояний ФС II с окисленным первичным хинонным акцептором QA на несколько порядков меньше по сравнению с вкладом состояний, содержащих в своем составе восстановленный QA–. Этот результат находится в соответствии с имеющимися представлениями о том, что флуоресценция объекта пропорциональна концентрации так называемых закрытых (т.е. содержащих в своем составе QA– ) реакционных центров ФС II [9]. Поэтому в дальнейшем при анализе кривых индукции флуоресценции мы ограничимся рассмотрением кинетики флуоресцирующих состояний ФС II с восстановленным QA– . В нашей модели этим состояниям соответствуют 4 переменные:
x6 = [Chl*Phe QA– QB], y6 = [Chl*Phe QA– QB–],
g6 = [Chl*Phe QA– ], z6.= [Chl*Phe QA–
QB],
где символ обозначает пустой сайт связывания вторичного хинного акцептора QB.
Из рис. 2 (б) видно, что относительный вклад каждой флуоресцирующей формы меняется в зависимости от интенсивности освещения. Так, при низких интенсивностях света флуоресценция излучается в основном состояниями g6 (состояние хинонного акцепторного комплекса с восстановленным QA – и не занятым QB сайтом) и z6 (хинонный комплекс в состоянии QA– QB2‑).
При средних интенсивностях освещения флуоресценция системы также в основном определяется суммой концентраций двух состояний (g6 и z6), хотя относительный вклад во флуоресценцию форм x6 и y6 несколько увеличивается.
При больших значениях световых констант (высокие интенсивности освещения) относительный вклад во флуоресценцию состояний x6 и y6 становится сравнимым по величине с вкладом z6 и g6, поскольку характерное время образования возбужденных состояний становится сравнимым с временем переноса электрона с QA на QB. В кинетике нарастания флуоресценции становятся четко различимы две промежуточные фазы J и I, причем в формировании фазы J принимают участие x6 и y6, тогда как в формировании I в основном участвует состояние z6. Форма g6 вносит свой вклад в обе кинетические фазы.
В соответствии с проведенным анализом природы кинетических компонентов индукционной кривой можно сделать вывод о происхождении ее отдельных фаз J, I и Р. Пик флуоресценции P соответствует по времени достижению максимума суммарной концентрации флуоресцирующих состояний ФСII с «полностью закрытым» хинонным акцепторным комплексом (состояния g6 и z6). Фаза I может быть довольно отчетливо выделена при любой интенсивности освещения, время ее достижения сокращается при увеличении интенсивности света. Как видно из рис.2(а) и 2(б), ее наступление примерно соответствует появлению промежуточного максимума на кривой нарастания концентрации состояния z6 (состояние с полностью восстановленным хинонным акцепторным комплексом). Фаза J отчетливо проявляется только при высоких интенсивностях освещения и связана с накоплением флуоресцирующих форм ФС II с «не полностью» восстановленным хинонным акцепторным комплексом (на QB не более одного электрона).
Особый интерес представляет выяснение причин появления немонотонности в кинетике нарастания концентрации состояния z6, поскольку именно этот эффект обусловливает появление фазы I на индукционной кривой.
Следует отметить, что появление дополнительного максимума на кинетике z6 коррелирует по времени с появлением «второй волны» трансмембранного электрического потенциала DY. Это особенно отчетливо прослеживается для низких значений световых констант (Рис.2а). В терминах нашей модели DY в каждый момент времени определяется разностью зарядов компартментов люмена и стромы. На рис. 2(в) показано изменение во времени скоростей процессов, участвующих в генерации и потреблении электрического заряда в люмене. Из рисунка видно, что появление «медленной фазы» потенциала соответствует по времени установлению некоторого «квазистационарного» состояния в системе генерации заряда в люмене тилакоида. Это означает, что в период примерно с 50 по 600 мс различные скорости генерации и потребления заряда в люмене «уравновешивают» друг друга. В интервале 50 -200 мс возрастает поток протонов в люмен, обусловленный окислением пластохинола на люменальной стороне bf комплекса (кривая H+bf на рис. 2(в)). Это связано с тем, что при данной интенсивности освещения в этом интервале времен в фотосистеме II происходит накопление состояний с полностью восстановленным вторичным хинонным акцептором QB, способным протонироваться и диссоциировать от ФС II приводя к восстановлению пула пластохинонов на стромальной стороне тилакоидной мембраны. Накопление пластохинола в свою очередь «запускает» работу bf комплекса. Поступление протонов в люмен тилакоида от кислородвыделяющего комплекса (кривая H+КВК) и от bf комплекса уравновешивается утечкой ионов K+ (K+leak) и потреблением протонов в АТФ-синтазной реакции (H+АТФ). Кроме того, некоторая часть протонов акцептируется буфером (данные не приведены). Результатом этих процессов является появление медленной фазы в кинетике трансмембранного электрического потенциала, что в свою очередь ведет к торможению реакций переноса электрона в потенциал-зависимых реакциях ФС II. Торможение электронного переноса приводит к замедлению нарастания концентрации состояния z6, возникновению промежуточного минимума в кинетике этого состояния (рис. 2б), и как следствие – к появлению соответствующей немонотонности (фазы I) на индукционной кривой (рис. 2а).
Распад квазистационарного состояния в системе генерации и потребления заряда в люмене тилакоида на временах порядка 300-600 мс (рис.2(в)), по всей видимости, связан с активизацией процессов в ФС I. При этом возрастает циклический транспорт электронов, в результате чего возникает конкуренция за пластохинон между фотосистемой II и bf комплексом. Следствием этого процесса является возрастание концентрации состояний ФС II с незаполненным QB сайтом. Кроме того, увеличивается степень восстановленности гемов bl и bh в комплексе цитохромов, что ведет к замедлению процессов реокисления пластохинола на люменальной стороне bf . В результате этого увеличивается концентрация пластохинола PQH2 в фазе тилакоидной мембраны и, как следствие, возрастает концентрация состояний ФС II с восстановленным QB акцептором . Увеличение концентраций флуоресцирующих форм g6 и z6 в свою очередь приводит к росту флуоресценции на участке DP.
Таким образом, нам удалось в рамках единой модели получить описание быстрой фазы индукции флуоресценции хлорофилла для любой интенсивности освещения объекта (от высокой до низкой), что отличает нашу модель от известных моделей [7, 9], разработанных для частных случаев только высокой или только низкой интенсивности освещения.
Наряду с тем, что модель позволяет анализировать состав флуоресцентного сигнала в широком диапазоне интенсивностей освещения, она также дает возможность исследовать в деталях процесс генерации трансмембранного электрического потенциала DY и градиента протонов DрН на мембране тилакоида, ионные потоки и ряд других важных характеристик первичных фотосинтетических процессов. Применение модели к описанию этих процессов является предметом наших дальнейших исследований.
Работа выполнена при поддержке РФФИ, грант № 00-04-48919
Список литературы
1.Dau H. // J.Photochem. Photobiol. B: Biology. 1994. V. 26. P. 3-
2.Dau H //
Photochem. Photobiol. 1994. V. 60. P. 1 -23.
3.Krause G.H. & Weis E. // Ann Rev. Plant. Physiol. Plant. Mol. Biol. 1991. V.42. P.313-349
4.Lazar D. //
Biochim. Biophys. Acta. 1999. V.1412. P.1-28
5.Trissl H.-W., Gao Y. and Wulf K. // Biophys.J. 1993. V.64. P. 974-988
6.Renger G., Shulze A. // Photobiochem. Photobiophys. 1985. V. 9. P. 79-87.
7.Baake E., Shloeder J.P. // Bull. Math. Biol. 1992. V. 54. P. 999-1021
8.Hsu B.-D. //
Biochim. Biophys. Acta. 1992. V. 1140. P.30-36.
9.Stirbet A., Govindjee, Strasser B.J. & Strasser R.J. // J. Theor. Biol. 1998. V.193.
P.131-151
10.Кукушкин А. К. , Тихонов А.Н. // Биофизика. 1979. Т.24, вып.1. С.87-91
11.Кукушкин А.К., Тихонов А.Н. Лекции по биофизике фотосинтеза высших растений. М.: Изд-во МГУ, 1988.
12.Дубинский А.Ю., Тихонов А.Н. // Биофизика. 1994. Т.39, вып.4. С.652-
13.Караваев В.А. // Биофизика. 1988. Т. 33, вып.5. С.876-877
14.Hsu B.-D., Lee Y.-S., & Jang I.-R. // Biochim. Biophys. Acta. 1989. V.975.
P.44-49
15.Vredenberg W.J. // Biophys. J. 2000. V.79. P. 26-38.
16.Lebedeva G.V., Belyaeva N.E., Ruznichenko G.Yu., Demin O.V. // BioThermoKinetics in the Post
genomic Era / Eds C. Larsson, I. Pahlman and L. Gustafsson . Goteborg: Chalmers
Reproservice, 1998. P. 196-199.
17.Riznichenko G.Yu., Lebedeva G.V., Demin O.V., Rubin A.B. // Journal of Biological Physics. 1999. V. 25. P.177-192.
18.Ризниченко Г.Ю., Лебедева Г.В., Демин О.В., Беляева Н.Е., Рубин А.Б. // Биофизика. 2000. Т.45, вып. 3. С.452-460.
19.Лебедева Г.В., Беляева Н.Е., Ризниченко Г.Ю., Рубин А.Б., Дёмин О.В. // Физ. химия. 2000. Т.74. C.1897-1906.
20.Беляева Н.Е., Демин О.В., Лебедева Г.В.,
Ризниченко Г.Ю., Рубин А.Б. // Математика. Компьютер. Образование. М.:
Прогресс-Традиция. 2001. Вып.8. С.587-595.
21.Strasser R.J., Srivastava A., Govindgee // Photochemistry and Photobiology. 1995. V.61. P.32-42.