РОЛЬ БИДОМЕННОЙ МОДЕЛИ В ИЗУЧЕНИИ МЕХАНИЗМОВ ЭЛЕКТРИЧЕСКОЙ СТИМУЛЯЦИИ СЕРДЦА
Самбелашвили
А.Т., Ефимов И.Р.
(Cleveland, Ohio, USA)
1.1. Введение
Серце является первым функционирующим органом при зарождении жизни и, как правило, с его остановкой связано прекращение жизни. Именно болезни сердечно-сосудистой системы являются ведущей причиной смертности в России, Европе, США и всём развитом мире. Каждое сокращение сердца запускается электрическим импульсом, генерирующимся в синусовом узле и распространяющимся в виде незатухающей волны деполяризации клеток сердца, соединённых в непрерывный синцитий. Эта волна синхронизирует механическое сокращение камер сердца. Именно нарушения возникновения или распространения волны деполяризации миокарда является наиболее частой непосредственной причиной смерти.
Клинический арсенал лечения заболеваний сердца включает фармакологические и хирургические методы. Однако, за последние полвека к ним добавилась и выдвинулась на ведущее место электрическая стимуляция сердца, ставшая одним из важнейших терапевтических методов восстановления нормального кровообращения. Миллионы людей в настоящее время живы буквально благодаря аресту внезапной сердечной смерти с помощью дефибрилляции (шоковой терапии) или благодаря имплантированным в их грудь стимуляторам или дефибрилляторам. Кроме того, электрическая стимуляция является важным методом клинических и фундаментальных исследований электрофизиологических механизмов функции сердца.
Исследования фундаментальных механизмов стимуляции имеют длинную историю, насчитывающую более трёх столетий (1-3). Однако, до недавнего времени эти исследования были затруднены отсутствием адекватных теоретических и экспериментальных методов, позволявшим бы предсказывать и измерять трансмембранный потенциала клеток во время стимуляции. Классические электродные методы, разработанные в XIX и XX столетиях, не позволяли вести такие измерения из-за сильного артефакта возникающего во время стимуляции.
Необходимые методики появились лишь в последние две декады XX века. Это экспериментальная методика – флуоресцентное картирование трансмембранного потенциала с помощью потенциал-чуствительных красителей. И теоретическая методика, основанная на формализме бидоменных моделей. Эта работа является обзором роли бидоменной модели в изучении механизмов стимуляции сердца.
1.2. Физиология
возбуждения сердечного синцития
В рамках бидоменной модели, сердечный синцитий можно представить в виде двух трёх-мерных пространств, описывающих внутриклеточное и внеклеточное пространства. Эти два пространства соединены между собой пассивным сопротивлением мембраны и активными ионными токами, зависящими от разницы потенциалов на мембране и времени. В покое, существует поляризация или разница потенциалов между двумя пространствами, известаня как потенциал покоя, равный -80-90 миливольт. Для возникновения и распространения волны возбуждения необходима начальная деполяризая сердечной мембраны в группе клеток. Такая деполяризация может быть вызвана с помошью внутриклеточной и внешенеклеточной стимуляции. При внутриклеточной стимуляции микроэлектрод вводится внутрь клетки с диаметром в 10-20 микрометров, что делает этот метод неприменимым в клинической ситуации. Внешнеклеточная стимуляция достигается путём импульса тока, распространяющегося во внешнеклеточной плазме. Однако этот импульс также вызывает изменение потенциала во внутриклеточном пространстве и меняет трансмембранный потенциал.
Начальная надпороговая деполяризация вызывает активацию натриевых каналов, начинающую генерацию потенциала действия. Эта локальная деполяризация диффундирует в соседние клетки и вызывает новую деполяризацию, открывающую натриевые каналы уже в этих соседних клетках. И так далее. Таким образом запускается тригерная волну возбуждения, известная так же как автоволна (4). Точечные ионные механизмы деполяризации на клеточном уровне известны достаточно детально и описаны во многих прекрасных обзорах и монографиях (5). Однако пространственные механизмы деполяризации остаются малоизученными. Бидоменная модель позволила значительно продвинуть исследования именно пространсвенных механизмов стимуляции.
1.3.
Бидоменная модель миокарда
Бидоменная модель
получила в последнее время широкое распространение в качестве основного подхода
при теоретическом и численном исследовании макроскопических электрических
явлений в сердечной ткани. Эта модель основана на представлении сердечной мышцы
в виде двух взаимопроникающих пространств – внутриклеточного и внеклеточного,
каждое из которых имеет различные коэффициенты проводимости вдоль и поперек
направления волокон (6-11). Состояние системы
описывается внутриклеточным ![]() и внеклеточным
и внеклеточным ![]() потенциалами как
функциями на некоторой пространственной области
потенциалами как
функциями на некоторой пространственной области ![]() . Искомой переменной является трансмембранный потенциал
(напряжение), определенный как разность
. Искомой переменной является трансмембранный потенциал
(напряжение), определенный как разность ![]() . Бидоменная модель заключается в следующей паре уравнений
реакции-диффузии:
. Бидоменная модель заключается в следующей паре уравнений
реакции-диффузии:
![]() (1)
(1)
![]() на
на ![]() (2)
(2)
здесь через ![]() и
и ![]() обозначены тензоры
внутриклеточной и внеклеточной проводимости соответственно,
обозначены тензоры
внутриклеточной и внеклеточной проводимости соответственно, ![]() - объемная плотность
трансмембранного тока,
- объемная плотность
трансмембранного тока, ![]() - объемная плотность
тока стимуляции.
- объемная плотность
тока стимуляции.
Трансмембранный ток представлен в виде суммы конденсаторного, ионного токов и тока электропорации (12;13):
![]() (3)
(3)
где ![]() - отношение
поверхности миоцита к его объему,
- отношение
поверхности миоцита к его объему, ![]() - емкость
трансмембранного конденсатора на единицу поверхности мембраны миоцита,
- емкость
трансмембранного конденсатора на единицу поверхности мембраны миоцита, ![]() - трансмембранная
проводимость вследствие электропорации. Последний член, как правило,
описывается эмпирическим дифференциальным уравнением первой степени, отражающим
процессы образования и заживления пор в мембране.
- трансмембранная
проводимость вследствие электропорации. Последний член, как правило,
описывается эмпирическим дифференциальным уравнением первой степени, отражающим
процессы образования и заживления пор в мембране.
Алгоритм вычисления ионного тока ![]() зависит от конкретной
модели сердечной клетки. Существует значительное количество таких моделей, от
простых и менее точных (14) до более сложных и более
адекватных Luo-Rudy phase I (15), Luo-Rudy phase II (16;17). В основе все эти модели
описывают свойства различных ионных каналов в рамках формализма Ходжкина-Хаксли
(18). С математической точки
зрения - это системы обыкновенных дифференциальных уравнений первой степени с
коэффициентами, зависящими от значения трансмембранного потенциала.
зависит от конкретной
модели сердечной клетки. Существует значительное количество таких моделей, от
простых и менее точных (14) до более сложных и более
адекватных Luo-Rudy phase I (15), Luo-Rudy phase II (16;17). В основе все эти модели
описывают свойства различных ионных каналов в рамках формализма Ходжкина-Хаксли
(18). С математической точки
зрения - это системы обыкновенных дифференциальных уравнений первой степени с
коэффициентами, зависящими от значения трансмембранного потенциала.
Если не рассматривать процессы, связанные с динамикой проводимости ионных каналов в зависимости от времени и трансмембранного потенциала, а просто считать ионные каналы имеющими фиксированное сопротивление, то ионный ток будет определяться законом Ома (19;20) :
![]() (4)
(4)
где ![]() - трансмембранное
сопротивление. В этом случае бидоменную модель принято называть пассивной.
- трансмембранное
сопротивление. В этом случае бидоменную модель принято называть пассивной.
Для того, чтобы бидоменная модель была полностью определена, необходимо указать граничные условия для системы уравнений (1) – (2). Последние могут варьироваться в зависимости от конкретной постановки задачи (11). Простейшими и наиболее часто используемыми граничными условиями являются условия непроводимости, т.е. отсутствие токов в/из внутри-/внеклеточного пространств:
![]()
![]() on
on ![]() (5)
(5)
здесь ![]() - вектор нормали к
границе
- вектор нормали к
границе ![]() .
.
Возможны и другие типы граничных условий:
![]()
![]() on
on ![]() (6)
(6)
или
![]()
![]() (7)
(7)
если ![]() «бесконечно» удалена
от рассматриваемого участка. Можно показать (11), что различные граничные
условия (5) – (7) приводят к похожим результатам при удовлетворении некоторых
общих требований.
«бесконечно» удалена
от рассматриваемого участка. Можно показать (11), что различные граничные
условия (5) – (7) приводят к похожим результатам при удовлетворении некоторых
общих требований.
1.4. Функция активации
Часто пару уравнений бидоменной модели (1) – (2) переписывают в
терминах трансмембранного потенциала ![]() и внеклеточного
потенциала
и внеклеточного
потенциала ![]() . Простой заменой переменных легко убедиться, что система в
этом случе принимает вид:
. Простой заменой переменных легко убедиться, что система в
этом случе принимает вид:
![]() (8)
(8)
![]() (9)
(9)
В начальный момент приложения электрического стимула в период
диастолы градиентом трансмембранного потенциала в уравнении (9) можно
пренебречь, равно как можно пренебречь и суммарным трансмембранным током. Таким
образом единственным источником изменения трансмембранного потенциала является
член ![]() в правой части (9), получивший
название обобщенной функции активации (21;22). Элементарное тождество:
в правой части (9), получивший
название обобщенной функции активации (21;22). Элементарное тождество:
![]() (10)
(10)
показывает, что причиной электрической активации сердечной мышцы могут быть как неоднородности внешнего электрического поля, так и неоднородности внутриклеточной проводимости. Важно подчеркнуть, что до недавнего времени, первый член правой части уравнения 10 не принимался во внимание и возбуждение клеток связывалось с градиентом внеклеточного потенциала (второй член уравнения) (23). Как показывает это уравнение, оба члена уравнения могут играть важную роль в стимуляции.
2.0. Механизмы точечной стимуляции
2.1. Виртуальные электроды при точечной стимуляции миокарда: линейная
модель
Бидоменная модель сердечной ткани значительно углубила понимание механизмов стимуляции сердца. В 1989 году группой Wikswo (19) была рассмотрена задача о точечной стимуляции плоской двумерной модели сердечной ткани, подчиняющейся бидоменным уравнениям (1) – (2) с пассивными ионнами токами. Было показано, что после приложения стимула вблизи стимулирующего электрода образуются характерная картина смежных областей деполяризации и гиперполяризации как результат неравной анизотропии вне- и внутриклеточного пространств (см. Рис 1AB). Этой характерной формы области поляризации в виде «собачьей кости» (doge-bone shape) не наблюдается в случае, если отношения проводимостей для этих внутри- и внеклеточного пространств одинаковое (случай равной анизотропии обоих пространств) – точка стимуляции тогда просто окружена эллипсом равномерно спадающей деполяризации/гиперполяризации при катодном/анодном стимуле. Таким образом, неравная анизотропия двух простраств обусловливает образование смежных областей противоположной поляризации, получивших название виртуальных анодов (гиперполяризация) и виртуальных катодов (деполяризация). Это опредение виртуальных электродов справедливо для стимуляциии электрическими полями любой пространсвенной конфигурации. Положительная часть функции активации соотвествет виртуальному катоду, так как она приводит к деполяризации, в то время как отрицательная часть функции активации соотвествет виртальному аноду.
Описанные результаты предложили убедительное объяснение феномену анодной стимуляции. Анодный ток гиперполяризует ткань непосредственно под электродом, что ставило в тупик многие поколения исследователей, не понимавших как гиперполяризация может вызвать в конечном итоге потенциал дейцствия, наблюдавшийся экспериментально. Бидоменная теория показала, что одновременно с виртуальными анодом (гиперполяризацией) возле электрода существуют виртуальные катоды на некотором расстоянии от него вдоль направления волокон. Именно в этих областях развивается деполяризация, и, при достаточной силе тока, возможно достижение порога возбуждения с последующей активацией сердечной мышцы.
Гипотеза виртуальных электродов получила блестящее подтверждение в экспериментах с использованием флюоресцентных красителей для картирования трансмембранного потенциала на поверхности эпикарда (см. Рис 1CD) во время монополярной (24-26) и биполярной стимуляции (27;28). Этот совместный успех бидоменной модели и флюоресцентной техники дал толчок интенсивным исследованиям стимуляции и дефибрилляции в рамках данной концепции. В частности, было показано теоретически, что для пассивной модели геометрия виртуальных электродов не зависит от силы тока, а определяется лишь значениями проводимостей, характеризующих среду (11). Отношение максимумов значения трансмембранного потенциала в областях противоположной полярности равно 10:1, но быстро снижается до 3:1 с увеличением размера стимулирующего электрода (29). Именно последнее отношение анодного к катодному порогов возбудимости при точечной стимуляции наблюдается в эксперименте. Вычисления на основе бидоменной модели в трех измерениях с учетом наличия омывающей стенки сердца жидкости показали, что жидкость ослабляет эффект виртуальных электродов, снижая анизотропию вследствие своей высокой проводимости (30).
2.2. Нелинейная модуляция виртуальных электродов
Виртуальные электроды были предсказаны на основе линейной пассивной бидоменной модели. Рассмотрение стимуляции как динамического процесса с учетом нелинейных свойств ионных каналов вносит значительные дополнения в первоначально простую картину. Реакция ткани на стимуляцию становится ассимметричной в случае токов различной полярности. Например, для слабых стимулов, приложенных в период диастолы, центральная область виртуального катода значительно больше по размеру, чем область виртуального анода во время анодной стимуляции (31). Этот феномен обусловлен нелинейностью калиевых каналов, ответственных за поддержание трансмембранного потенциала покоя. Подобная ассиметрия, но уже в сторону усиления гиперполяризации, наблюдается при стимуляции во время фазы плато, когда основную роль играют кальциевые ионные каналы (32;33). Механизмы ионной модуляции изменений трансмембранного потенциала при стимуляции до сих пор еще плохо понятны и являются темой текущих исследований нашей лаборатории.
2.3. Два механизма стимуляции: «make» и «break»
Прикладывая электрический импульс к сердченой ткани, которая находится в различных состояниях, соответсвующих различным фазам потенциала действия, можно заметить, что активация вследствие приложенного импулься происходит либо в начальный момент включения импулься, либо в момент сразу после его отключения (34). Эти два режима, известные около полувека, как «make»- и «break»- возбуждение соответственно (make- and break- excitation) (см. Рис 2) были недавно объяснены как теоретически (35), так и экспериментально (24), в рамках бидоменной модели.
Make–режим имеет место в случае, когда катодный или анодный импульс прикладывается к полностью возбудимой ткани, находящейся в периоде диастолы. При достаточном уровне деполяризации в области виртуального катода клетки достигают порога и вызывают рождение волны активации. Эта волна более вытянута вдоль направления волокон при анодной make-активации, а при катодной имеет более круговую форму.
Если электрический импульс приложен к сердечнок ткани в состоянии рефрактерности, то никакого фронта возбуждения не возникнет. Однако, в области виртуальных анодов, которая относительно гиперполяризована, произойдет ре-активация клеток, вызывающая восстановление возбудимости. После отключения импулься эти клетки возбудятся в результате диффузии потенциала из близлежащих деполяризованных областей виртуальных катодов, создавая таким образом субстрат для первоначального распространения волны возбуждения. К тому времени, когда волна пройдет через области виртуальных анодов, изначально рефрактерная ткань станет возбудимой снова и волна продолжит распространятся во всех направлениях.
Таким образом, при make-возбуждении активация происходит от виртуальных катодов сразу в момент после приложения стимула, а при break–возбужднии волна начинает распространяется по виртуальным анодам непосредственно после выключения стимула.
3.0. Механизмы провокации аритмий
3.1. История вопроса.
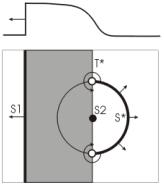
Возможности индуцирования (3) и прекращения (36) аритмии путем приложения электрического импульса были экспериментально обнаружены более столетия назад. Первое теоретическое объяснение механизма возбуждения аритмии было предложено в 40-х годах (37;38) (см. Рис 3). Их идея состоит в следующем: если нанести точечный стимул тока в хвост плоской волны возбуждения (на рисунке она проходит справа налево), то образовавшаяся в результате импульса круговая волна затухнет в рефрактерной области (обозначенной серым цветом по левую сторону от линии критической фазы Т*), но сможет распространяться в возбудимой ткани (белая область справа от Т*). Пересечение линий критической деполяризации S* и критической фазы Т* определяет две точки фазовой сингулярности – центры двух вихрей электрической активности, вращающихся во взаимно противоположных направлениях. Именно эти стабильные вихри могут являться центрами аритмогенеза (23;39).
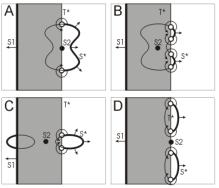
Вышеописанная теоретическая модель предполагает, что электрический точечный импульс создает круговую область деполяризации, что неверно. С учетом открытого позднее эффекта виртуальных электродов эта модель была пересмотрена и усовершенствована (40). В новой интерпретации возможно появление 2-х или 4-х роторов в зависимости от полярности стимула, времени его приложения и направления распространения первоначальной волны S1 (см Рис 4).
3.2. Фазовые сингулярности вызванные виртуальными электродами.
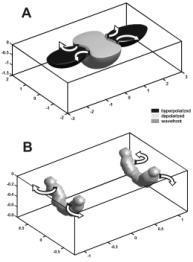
Феномен виртуальных электродов предсказывает возможность провокации аритмии вообще в отсутствие исходной неоднородности по рефрактерности (см Рис 5) (41-44). Если приложить импульс к относительно рефрактерной ткани, то, как описывалось выше, по выключении стимула произойдет процесс break–возбуждения, когда волна распространяется сначала через область виртуальных анодов. Эксперимент (45) и математическое моделирование (46) показали, что при достаточно сильном градиенте трансмембранного потенциала, в этом случае на границах между виртуальным катодом и анодами могут возникнуть две пары фазовых сингулярностей (на рисунке обозначены белыми кругами), приводящих к стабильной картине четырехкратного вращения (“quatrefoil reentry”). Этот механизм аритмогенеза известен как механизм фазовой сингулярность индуцированной виртуальными электродами (“virtual electrode induced phase singularity” см Рис. 6) (42).
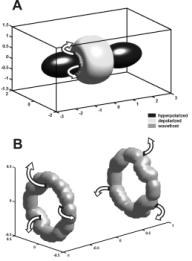
До недавнего времени анализ электрических явлений в сердце ограничивался двумерными моделями, тогда как в реальности сердечная мышца – это геометрически и морфологически сложный трехмерный объект. В трёх измерениях, вихрь примет форму волны в виде свитка, центром которого является нить свитка (47), соотвествующая положению области фазовой сингулярности в 3-х измерениях.. С развитием вычислительной техники появились трехмерные бидоменные модели, позволяющие рассматривать процессы, скрытые в толще ткани и пока не доступные исследованию экспериментальными методами. Например, моделирование механизма фазовой сингулярности, вызванной виртуальными электродами, показало, что пространственные кривые этой сингулярности, соответствующие трехмерному случаю, могут быть трех различных топологических видов в зависимости от соотношения силы импульса и толщины мышцы: в форме букв I, U и O (см Рис 7-9) (48). Для различных видов этих кривых проявление аритмии на поверхности сердца будет различным. В частности, если в случае I-сингулярности на поверхности эпикарда будут присутствовать роторы, то в случае O-сингулярности их не будет, а аритмообразующая волна активации будет прорываться на поверхность через определенные промежутки времени в виде эллиптического или подковообразного фронта распространения.
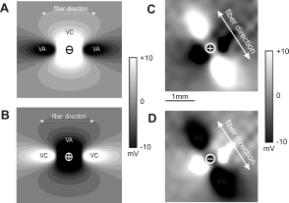
Рис. 1. Виртуальные электроды при точечной стимуляции миокарда; А – централный виртуальный катод (VC) и виртуальные аноды (VA) при стимуляции катодным током в двумерной бидоменной модели; B – виртуальные электроды при стимуляции анодным током в двумерной бидоменной модели; C – экспериментальная картина распределения трансмембранной поляризации на поверхности эпикарда при катодной стимуляции; D – эксперементальная картина, соответствующая анодной стимуляции
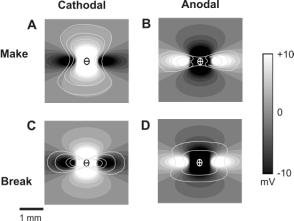
Рисунок 2. Make- и break- возбуждение для анодного и катодного точечных стимулов – схематическое представление. Контурные линии показывают положения фронта активации в последовательные моменты времени.
|
Рис. 3. Механизм возникновения фазовых сингулярностей при
приложении катодного стимула к хвосту плоской волны возбуждения. Серым
цветом обозначена область относительной рефрактерности, белым – возбудимая
ткань. S* - кривая критичекой деполяризации, соответствующая порогу
возбудимости, T* - кривая критической фазы, разделяющая рефрактерную и
возбудимую фазы потенциала действия. |
Рис. 4. Пересмотренный механизм образования фазовых сингулярностей с учетом
феномена виртуальных электродов. А – катодный импульс приложен в хвост волны
S1; B – случай А с более ранним временем приложения точечного импулься S2; С
– анодный импульс, в ситуации, когда исходная волна распространяется вдоль направления волокон; D – анодный
импульс в ситуации, когда исходная волна распространяется перпендикулярно
направлению волокон. |

Рис. 5. Механизм образования фазовой сингулярности вызванной эффектом вируальных электродов. Серым цветом показана исходная область относительной рефрактерности, черным – область виртуального катода, белым – области виртуальных анодов. Положение фазовых сингулярностей обозначено кружками, соединенными линиями, соответствующими начальному положению фронта возбуждения.
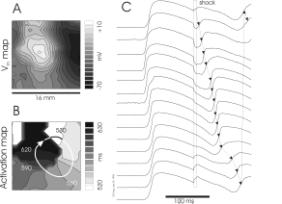
Рис. 6. Экспериментальное свидетельство существования фазовой сингулярности вызванной эффектом виртуальных электродов. A – карта распределения трансмембранного потенциала; B – карта изохрон при распространении импулься; C - оптический сигнал, отражающий зависимость трансмембранного потенциала от времени в разных точках рассматриваемой области.
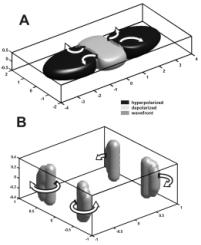
Рис. 7. I-образные нити фазовой сингулярности: результат трехмерной бидоменной модели. Черный цвет в A соответствует виртуальным анодам, серый – виртуальному катоду. В - I-образные нити фазовой сингулярности, образующиеся на границе между фронтом возбуждения и исходно рефрактерной средой. Стрелками показано направления распространения фронта возбуждения.
|
Рис. 8. U-образные нити фазовой сингулярности: результат трехмерной бидоменной модели. Черный цвет в A соответствует виртуальным анодам, серый – виртуальному катоду. В - U-образные нити фазовой сингулярности, образующиеся на границе между фронтом возбуждения и исходно рефрактерной средой. Стрелками показано направления распространения фронта возбуждения. |
Рис. 9. O-образные нити фазовой сингулярности: результат трехмерной бидоменной модели. Черный цвет в A соответствует виртуальным анодам, серый – виртуальному катоду. В - O-образные нити фазовой сингулярности, образующиеся на границе между фронтом возбуждения и исходно рефрактерной средой. Стрелками показано направления распространения фронта возбуждения. |
Список литературы:
1.Swammerdam, J., Biblia Naturae. Leyden:
H.Boerhaave; 1738.
2.Galvani, L. De Vibribus Electricitatis in Motu Musculari.
Commentarius. De Bononiesi Scientarium et Ertium Instituto atque Academia
Commentarii 1791;7:363-416.
3.Hoffa, M. and Ludwig, C. Einige Neue Versuche
Uber Herzbewegung. Zeitschrift Rationelle Medizin 1850;9:107-44.
4.Krinsky, V. I., Biktashev, V. N., and Pertsov,
A. M. Autowave Approaches to Cessation of Reentrant Arrhythmias. Ann N Y Acad
Sci 1990;591:232-46.
5.Noble, D., The Initiation of the Heartbeat.
Oxford: Clarendon Press; 1975.
6.Muler, A. L. and Markin, V. S. [Electrical
Properties of Anisotropic Neuromuscular Syncytia. II. Distribution of a Flat
Front of Excitation]. Biofizika 1977;22(3):518-22.
7.Muler, A. L. and Markin, V. S. [Electrical
Properties of Anisotropic Neuromuscular Syncytia. III. Steady State of the
Front of Excitation]. Biofizika 1977;22(4):671-5.
8.Muler, A. L. and Markin, V. S. [Electrical
Properties of Anisotropic Neuromuscular Syncytia. I. Distribution of the
Electrotonic Potential]. Biofizika 1977;22(2):307-12.
9.Tung, L. A bidomain model for describing
ischemia myocardial DC potentials.
Massachusetts Institute of Technology; 1978.
10.Geselowitz, D.
B. and Miller WT, 3. d. A Bidomain Model for Anisotropic Cardiac Muscle. Ann
Biomed Eng 1983;11(3-4):191-206.
11.Henriquez, C. S. Simulating the
Electrical Behavior of Cardiac Muscle Using the Bidomain Model. Crit Rev Biomed
Eng 1993;21:1-77.
12.DeBruin, K. A.
and Krassowska, W. Electroporation and Shock-Induced Transmembrane Potential in
a Cardiac Fiber During Defibrillation Strength Shocks. Ann.Biomed Eng
1998;26(4):584-96.
13.Skouibine, K., Trayanova, N., and
Moore, P. A Numerically Efficient Model for Simulation of Defibrillation in an
Active Bidomain Sheet of Myocardium. Math.Biosci. 2000;166(1):85-100.
14.Beeler, G. W. and Reuter, H.
Reconstruction of the Action Potential of Ventricular Myocardial Fibres.
J.Physiol.(Lond.) 1977;268(1):177-210.
15.Luo, C. H. and Rudy, Y. A Model of
the Ventricular Cardiac Action Potential: Depolarization, Repolarization, and
Their Interaction. Circ Res 1991;68(6):1501-26.
16.Luo, C. H. and Rudy, Y. A Dynamic
Model of the Cardiac Ventricular Action Potential. I. Simulations of Ionic
Currents and Concentration Changes. Circ Res 1994;74(6):1071-96.
17.Luo, C. H. and Rudy, Y. A Dynamic
Model of the Cardiac Ventricular Action Potential. Ii. Afterdepolarizations,
Triggered Activity, and Potentiation. Circ Res 1994;74(6):1097-113.
18.Noble, D. The Initiation of the
Heart Beat. Advancement of Science 1966;23(114):412-8.
19.Sepulveda, N. G., Roth, B. J., and
Wikswo, J. P. Current Injection into a Two-Dimensional Anisotropic Bidomain. Biophysical
Journal 1989;55(5):987-99.
20.Plonsey, R and Barr, R. C.,
Bioelectricity: a quantitative approach. New York: Plenum Press; 1988.
21.Rattay, F. Ways to Approximate
Current-Distance Relations for Electrically Stimulated Fibers [Published
Erratum Appears in J Theor Biol 1987 Oct 21;128(4):527]. J Theor.Biol.
4-7-1987;125(3):339-49.
22.Sobie, E. A., Susil, R. C., and
Tung, L. A Generalized Activating Function for Predicting Virtual Electrodes in
Cardiac Tissue. Biophysical Journal 1997;73(3):1410-23.
23.Frazier, D. W., Wolf, P. D.,
Wharton, J. M., Tang, A. S., Smith, W. M., and Ideker, R. E. Stimulus-Induced
Critical Point. Mechanism for Electrical Initiation of Reentry in Normal Canine
Myocardium. J.Clin.Invest. 1989;83(3):1039-52.
24.Wikswo, J. P., Lin, S.-F., and
Abbas, R. A. Virtual Electrodes in Cardiac Tissue: a Common Mechanism for
Anodal and Cathodal Stimulation. Biophysical Journal 1995;69:2195-210.
25.Neunlist, M. and Tung, L. Spatial
Distribution of Cardiac Transmembrane Potentials Around an Extracellular Electrode:
Dependence on Fiber Orientation. Biophysical Journal 1995;68(6):2310-22.
26.Knisley, S. B. Transmembrane Voltage
Changes During Unipolar Stimulation of Rabbit Ventricle. Circulation Research
1995;77(6):1229-39.
27.Nikolski, V. and Efimov, I. R.
Virtual Electrode Polarization of Ventricular Epicardium During Bipolar
Stimulation. J Cardiovasc Electrophysiol 2000;11(5):605.
28.Nikolski, V. P., Sambelashvili, A.
T., and Efimov, I. R. Mechanisms of Make and Break Excitation Revisited:
Paradoxical Break Excitation During Diastolic Stimulation. Am.J Physiol Heart
Circ.Physiol 2002;282(2):H565-H575.
29.Patel, S. G. and Roth, B. J. How Electrode Size Affects the Electric Potential Distribution in Cardiac Tissue. IEEE Trans.Biomed.Eng 2000;47(9):1284-7.
30.Latimer, D. C. and Roth, B. J. Effect of a Bath on the Epicardial Transmembrane Potential During Internal Defibrillation Shocks. IEEE Trans.Biomed.Eng. 1999;46:612-4.
31.Nikolski, V.; Sambelashvili, A.; Efimov, I. R. Evidence of virtual electrode polarization during subthreshold stimuli. Circulation 104[17], II-4. 2001. Ref Type: Abstract
32.Zhou, X., Smith, W. M., Rollins, D. L., and Ideker, R. E. Transmembrane
Potential Changes Caused by Shocks in Guinea Pig Papillary Muscle. Am J Physiol
1996;271(6:Pt 2):Pt 2):H2536-46.
33.Efimov, I. R. A Shocking Experience: Ionic Modulation of Virtual Electrodes in Defibrillation. Circulation Research 9-15-2000;87(6):429-30.
34.Hoffman, B. F. and Cranefield, P. F., Electrophysiology of the Heart. New York: McGraw-Hill; 1960.
35.Roth, B. J. A Mathematical Model of Make and Break Electrical Stimulation of Cardiac Tissue by a Unipolar Anode or Cathode. IEEE Trans Biomed Eng 1995;42(12):1174-84.
36.Prevost, J. L. and Battelli, F. Sur Quel Ques Effets Des Dechanges Electriques Sur Le Coer Mammifres. Comptes Rendus Seances Acad Sci 1899;129:1267.
37.Wiggers, C. J. and Wegria, R. Ventricular Fibrillation Due to Single Localized Induction in Condenser Shock Supplied During the Vulnerable Phase of Ventricular Systole. American Journal of Physiology 1939;128:500.
38.Wiener, N and Rosenblueth, A. The Mathematical Formulation of the Problem of Conduction of Impulses in a Network of Connected Excitable Elements, Specifically in Cardiac Muscle. Arch.Inst.Cardiologia de Mexico 1946;16(3-4):205-65.
39.Winfree, A. T., When Time Breaks Down: the Three-Dimensional Dynamics of Electrochemical Waves and Cardiac Arrhythmias. Princeton, NJ: Princeton University Press; 1987.
40.Roth, B. J. The Pinwheel Experiment Revisited. Journal of Theoretical Biology 2-21-1998;190(4):389-93.
41.Efimov, I. R., Cheng, Y. N., Biermann, M., Van Wagoner, D. R., Mazgalev, T., and Tchou, P. J. Transmembrane Voltage Changes Produced by Real and Virtual Electrodes During Monophasic Defibrillation Shock Delivered by an Implantable Electrode. Journal of Cardiovascular Electrophysiology 1997;8:1031-45.
42.Efimov, I. R., Cheng, Y., Van
Wagoner, D. R., Mazgalev, T., and Tchou, P. J. Virtual Electrode-Induced Phase
Singularity: a Basic Mechanism of Failure to Defibrillate. Circulation Research
1998;82:918-25.
43.Cheng, Y, Mowrey, K. A., Van
Wagoner, D. R, Tchou, P. J., and Efimov, I. R. Virtual Electrode Induced
Re-Excitation: A Basic Mechanism of Defibrillation. Circulation Research
1999;85(11):1056-66.
44.Efimov, I. R., Cheng, Y, Yamanouchi,
Y., and Tchou, P. J. Direct Evidence of the Role of Virtual Electrode Induced
Phase Singularity in Success and Failure of Defibrillation. J Cardiovasc
Electrophysiol 2000;11(8):861-8.
45.Lin, F. C., Roth, B. J., and Wikswo
JP, J. r. Quatrefoil Reentry in Myocardium: an Optical Imaging Study of the Induction
Mechanism. J Cardiovasc Electrophysiol 1999;10:574-86.
46.Lindblom, A. E., Roth, B. J., and
Trayanova, N. A. Role of Virtual Electrodes in Arrhythmogenesis: Pinwheel
Experiment Revisited. J Cardiovasc Electrophysiol 2000;11(3):274-85.
47.Winfree, A. T. Scroll-Shaped Waves
of Chemical Activity in Three Dimensions. Science 1973;181:937-9.
48.Sambelashvili, A. and Efimov, I. R.
The Pinwheel Experiment Re-Revisited. J Theor.Biol. 1-21-2002;214(2):147-53.