Ясинская И. М., Розанов А. Я.
Кафедра биохимии Одесского Госуниверситета им. И.И. Мечникова. 270058 Одесса, Украина.
При помощи специально
разработанных методов исследовали механизм действия и пути регуляции
активности цитохрома Р450 ароматазы. NADРH
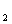
,
отдавая электрон, восстанавливает Fe
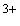
в
составе фермента до Fe
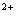
.
Fe
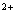
отдает
электрон кислороду, образуя супероксидный радикал, а само превращается
в Fe
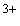
.
Fe
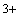
связывается
с супероксидом с образованием активного соединения FeOO
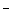
,
которое отнимает протон у NADP,
содержащего в данный момент два протона и один электрон, и превращается
в FeOOH.
FeOOH
реагирует с NADPH
с образованием воды и очень реакционно способного неустойчивого
комплекса FeO ,
который взаимодействует с тестостероном, гидроксилируя его в соответствующих
положениях. Изучены кинетика ароматазной реакции в различных условиях
(рассчитаны
Km
и
Vmax)
и влияние на активность фермента различных восстановителей (аскорбиновой
кислоты, гидрохинона, глутатиона-SH,
дитиотреитола, цистеина и некоторых других), активирующих цитохром
Р450 ароматазу, а также различных бифенилов (ДДТ и родственных
соединений) и близких к ним соединений, конкурентно ингибирующих
фермент. Рассмотрены возможные механизмы регуляции активности
цитохрома Р450 ароматазы данными соединениями. Составлены схемы,
отражающие механизмы действия и регуляции активности цитохрома
Р450 ароматазы (представлены в докладе).
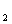 ,
отдавая электрон, восстанавливает Fe
,
отдавая электрон, восстанавливает Fe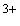 в
составе фермента до Fe
в
составе фермента до Fe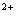 .
Fe
.
Fe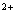 отдает
электрон кислороду, образуя супероксидный радикал, а само превращается
в Fe
отдает
электрон кислороду, образуя супероксидный радикал, а само превращается
в Fe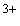 .
Fe
.
Fe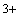 связывается
с супероксидом с образованием активного соединения FeOO
связывается
с супероксидом с образованием активного соединения FeOO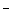 ,
которое отнимает протон у NADP,
содержащего в данный момент два протона и один электрон, и превращается
в FeOOH.
FeOOH
реагирует с NADPH
с образованием воды и очень реакционно способного неустойчивого
комплекса FeO ,
который взаимодействует с тестостероном, гидроксилируя его в соответствующих
положениях. Изучены кинетика ароматазной реакции в различных условиях
(рассчитаны Km
и Vmax)
и влияние на активность фермента различных восстановителей (аскорбиновой
кислоты, гидрохинона, глутатиона-SH,
дитиотреитола, цистеина и некоторых других), активирующих цитохром
Р450 ароматазу, а также различных бифенилов (ДДТ и родственных
соединений) и близких к ним соединений, конкурентно ингибирующих
фермент. Рассмотрены возможные механизмы регуляции активности
цитохрома Р450 ароматазы данными соединениями. Составлены схемы,
отражающие механизмы действия и регуляции активности цитохрома
Р450 ароматазы (представлены в докладе).
,
которое отнимает протон у NADP,
содержащего в данный момент два протона и один электрон, и превращается
в FeOOH.
FeOOH
реагирует с NADPH
с образованием воды и очень реакционно способного неустойчивого
комплекса FeO ,
который взаимодействует с тестостероном, гидроксилируя его в соответствующих
положениях. Изучены кинетика ароматазной реакции в различных условиях
(рассчитаны Km
и Vmax)
и влияние на активность фермента различных восстановителей (аскорбиновой
кислоты, гидрохинона, глутатиона-SH,
дитиотреитола, цистеина и некоторых других), активирующих цитохром
Р450 ароматазу, а также различных бифенилов (ДДТ и родственных
соединений) и близких к ним соединений, конкурентно ингибирующих
фермент. Рассмотрены возможные механизмы регуляции активности
цитохрома Р450 ароматазы данными соединениями. Составлены схемы,
отражающие механизмы действия и регуляции активности цитохрома
Р450 ароматазы (представлены в докладе).